Номер 37, страница 43 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2025
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
5. Теория электролитической диссоциации. Реакции ионного обмена. Упражнения и задачи для самостоятельного решения - номер 37, страница 43.
№37 (с. 43)
Условие. №37 (с. 43)
скриншот условия

37. Составьте уравнения реакций в молекулярной, полной и сокращённой ионной форме.
а) $CaCl_2 + Na_2CO_3 \rightarrow$
б) $NH_4Br + KOH \rightarrow$
в) $NaOH(\text{изб.}) + SO_2 \rightarrow$
г) $Mg + CH_3COOH \rightarrow$
Решение. №37 (с. 43)
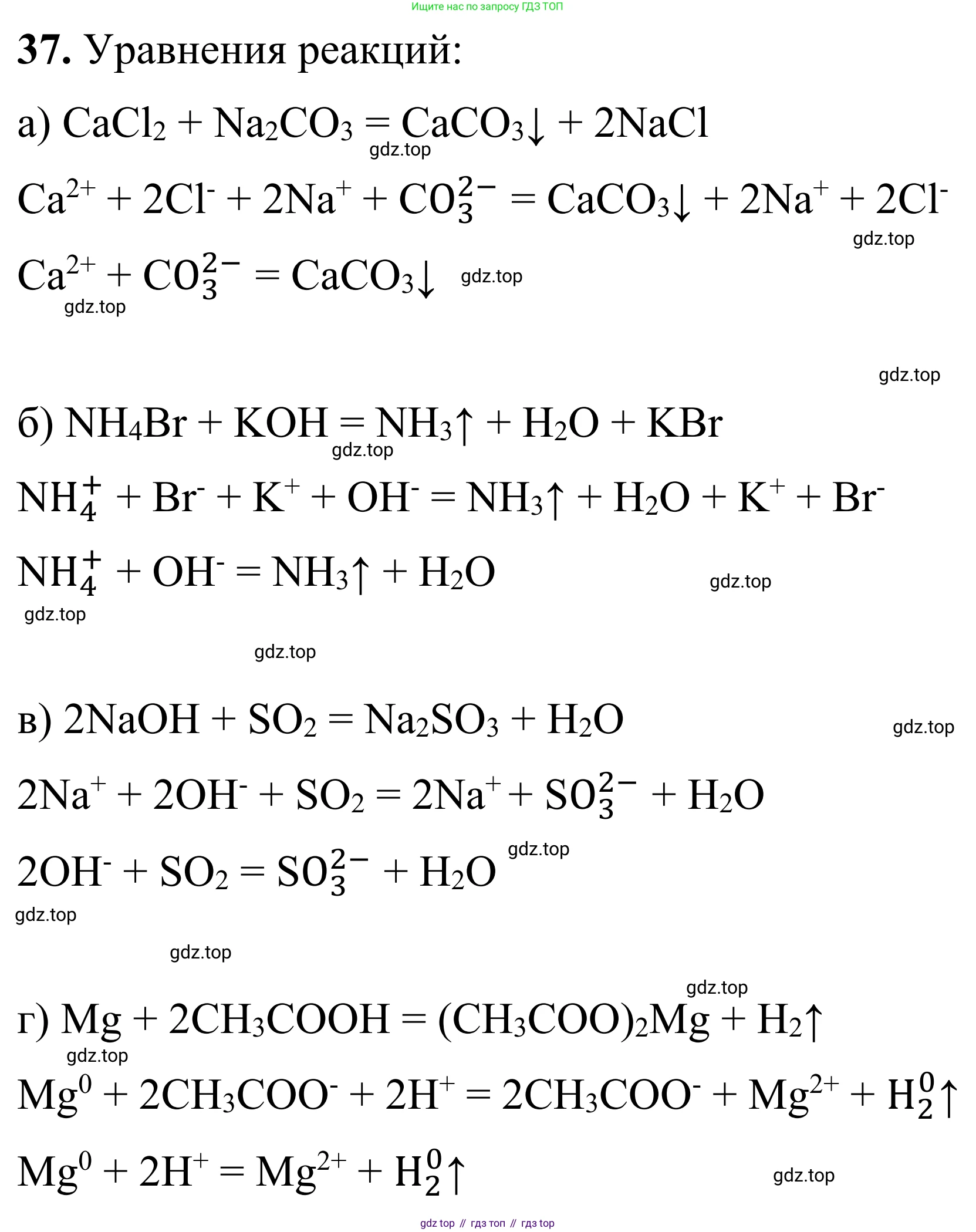
Решение 2. №37 (с. 43)
а) CaCl₂ + Na₂CO₃ →
Решение
Это реакция ионного обмена между двумя растворимыми солями: хлоридом кальция ($CaCl_2$) и карбонатом натрия ($Na_2CO_3$). Реакция протекает до конца, так как в результате образуется нерастворимый в воде осадок — карбонат кальция ($CaCO_3$).
1. Молекулярное уравнение. Записываем формулы исходных веществ и продуктов реакции, уравниваем количество атомов каждого элемента с помощью коэффициентов.
$CaCl_2 + Na_2CO_3 \rightarrow CaCO_3 \downarrow + 2NaCl$
2. Полное ионное уравнение. Записываем сильные растворимые электролиты ($CaCl_2, Na_2CO_3, NaCl$) в виде ионов. Нерастворимое вещество ($CaCO_3$) оставляем в молекулярном виде.
$Ca^{2+} + 2Cl^- + 2Na^+ + CO_3^{2-} \rightarrow CaCO_3 \downarrow + 2Na^+ + 2Cl^-$
3. Сокращённое ионное уравнение. Исключаем из полного ионного уравнения ионы-наблюдатели ($Na^+$ и $Cl^-$), которые не изменились в ходе реакции.
$Ca^{2+} + CO_3^{2-} \rightarrow CaCO_3 \downarrow$
Ответ:
Молекулярное уравнение: $CaCl_2 + Na_2CO_3 \rightarrow CaCO_3 \downarrow + 2NaCl$
Полное ионное уравнение: $Ca^{2+} + 2Cl^- + 2Na^+ + CO_3^{2-} \rightarrow CaCO_3 \downarrow + 2Na^+ + 2Cl^-$
Сокращённое ионное уравнение: $Ca^{2+} + CO_3^{2-} \rightarrow CaCO_3 \downarrow$
б) NH₄Br + KOH →
Решение
Это реакция ионного обмена между солью аммония (бромид аммония, $NH_4Br$) и сильным основанием (гидроксид калия, $KOH$). Реакция протекает, так как образуется слабое, нестабильное основание — гидроксид аммония ($NH_4OH$), который разлагается на газообразный аммиак ($NH_3$) и воду ($H_2O$).
1. Молекулярное уравнение.
$NH_4Br + KOH \rightarrow KBr + NH_3 \uparrow + H_2O$
2. Полное ионное уравнение. Растворимые сильные электролиты ($NH_4Br, KOH, KBr$) записываем в виде ионов. Газ ($NH_3$) и слабый электролит (вода, $H_2O$) — в молекулярном виде.
$NH_4^+ + Br^- + K^+ + OH^- \rightarrow K^+ + Br^- + NH_3 \uparrow + H_2O$
3. Сокращённое ионное уравнение. Сокращаем ионы-наблюдатели ($K^+$ и $Br^-$).
$NH_4^+ + OH^- \rightarrow NH_3 \uparrow + H_2O$
Ответ:
Молекулярное уравнение: $NH_4Br + KOH \rightarrow KBr + NH_3 \uparrow + H_2O$
Полное ионное уравнение: $NH_4^+ + Br^- + K^+ + OH^- \rightarrow K^+ + Br^- + NH_3 \uparrow + H_2O$
Сокращённое ионное уравнение: $NH_4^+ + OH^- \rightarrow NH_3 \uparrow + H_2O$
в) NaOH(изб.) + SO₂ →
Решение
Это реакция между кислотным оксидом (диоксид серы, $SO_2$) и сильным основанием (гидроксид натрия, $NaOH$). Так как щёлочь находится в избытке (указано "изб."), образуется средняя (нормальная) соль — сульфит натрия ($Na_2SO_3$) и вода.
1. Молекулярное уравнение.
$2NaOH + SO_2 \rightarrow Na_2SO_3 + H_2O$
2. Полное ионное уравнение. Сильные электролиты ($NaOH, Na_2SO_3$) записываем в виде ионов. Оксид ($SO_2$) и воду ($H_2O$) оставляем в молекулярной форме.
$2Na^+ + 2OH^- + SO_2 \rightarrow 2Na^+ + SO_3^{2-} + H_2O$
3. Сокращённое ионное уравнение. Сокращаем ион-наблюдатель ($Na^+$).
$2OH^- + SO_2 \rightarrow SO_3^{2-} + H_2O$
Ответ:
Молекулярное уравнение: $2NaOH + SO_2 \rightarrow Na_2SO_3 + H_2O$
Полное ионное уравнение: $2Na^+ + 2OH^- + SO_2 \rightarrow 2Na^+ + SO_3^{2-} + H_2O$
Сокращённое ионное уравнение: $2OH^- + SO_2 \rightarrow SO_3^{2-} + H_2O$
г) Mg + CH₃COOH →
Решение
Это реакция замещения между активным металлом (магний, $Mg$) и слабой кислотой (уксусная кислота, $CH_3COOH$). Магний стоит в ряду активности металлов левее водорода, поэтому он вытесняет водород из кислоты. В результате образуются соль (ацетат магния, $(CH_3COO)_2Mg$) и газообразный водород ($H_2$).
1. Молекулярное уравнение.
$Mg + 2CH_3COOH \rightarrow (CH_3COO)_2Mg + H_2 \uparrow$
2. Полное ионное уравнение. Магний ($Mg$) — простое вещество. Уксусная кислота ($CH_3COOH$) — слабый электролит, поэтому записывается в молекулярном виде. Ацетат магния ($(CH_3COO)_2Mg$) — растворимая соль, сильный электролит. Водород ($H_2$) — газ.
$Mg + 2CH_3COOH \rightarrow Mg^{2+} + 2CH_3COO^- + H_2 \uparrow$
3. Сокращённое ионное уравнение. В данном случае в левой и правой частях уравнения нет одинаковых ионов (ионов-наблюдателей), которые можно было бы сократить. Поэтому полное ионное уравнение является одновременно и сокращённым ионным уравнением.
$Mg + 2CH_3COOH \rightarrow Mg^{2+} + 2CH_3COO^- + H_2 \uparrow$
Ответ:
Молекулярное уравнение: $Mg + 2CH_3COOH \rightarrow (CH_3COO)_2Mg + H_2 \uparrow$
Полное ионное уравнение: $Mg + 2CH_3COOH \rightarrow Mg^{2+} + 2CH_3COO^- + H_2 \uparrow$
Сокращённое ионное уравнение: $Mg + 2CH_3COOH \rightarrow Mg^{2+} + 2CH_3COO^- + H_2 \uparrow$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 37 расположенного на странице 43 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №37 (с. 43), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















