Номер 41, страница 44 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
5. Теория электролитической диссоциации. Реакции ионного обмена. Упражнения и задачи для самостоятельного решения - номер 41, страница 44.
№41 (с. 44)
Условие. №41 (с. 44)
скриншот условия

41. Среди предложенных веществ выберите те, между которыми возможна:
1) окислительно-восстановительная реакция (составьте схему реакции, подберите коэффициенты с помощью метода электронного баланса, укажите окислитель и восстановитель);
2) реакция ионного обмена в водном растворе (составьте уравнение реакции в молекулярной, полной и сокращённой ионной форме).
a) $Na$, $Zn(OH)_2$, $H_2$, $HBr$
б) $CuO$, $HCl$, $Al(OH)_3$, $CO$
в) карбонат кальция, иодид калия, нитрат серебра, хлор
г) бромид аммония, гидроксид калия, перманганат калия, серная кислота
Решение. №41 (с. 44)

Решение 2. №41 (с. 44)
а) Na, Zn(OH)₂, H₂, HBr
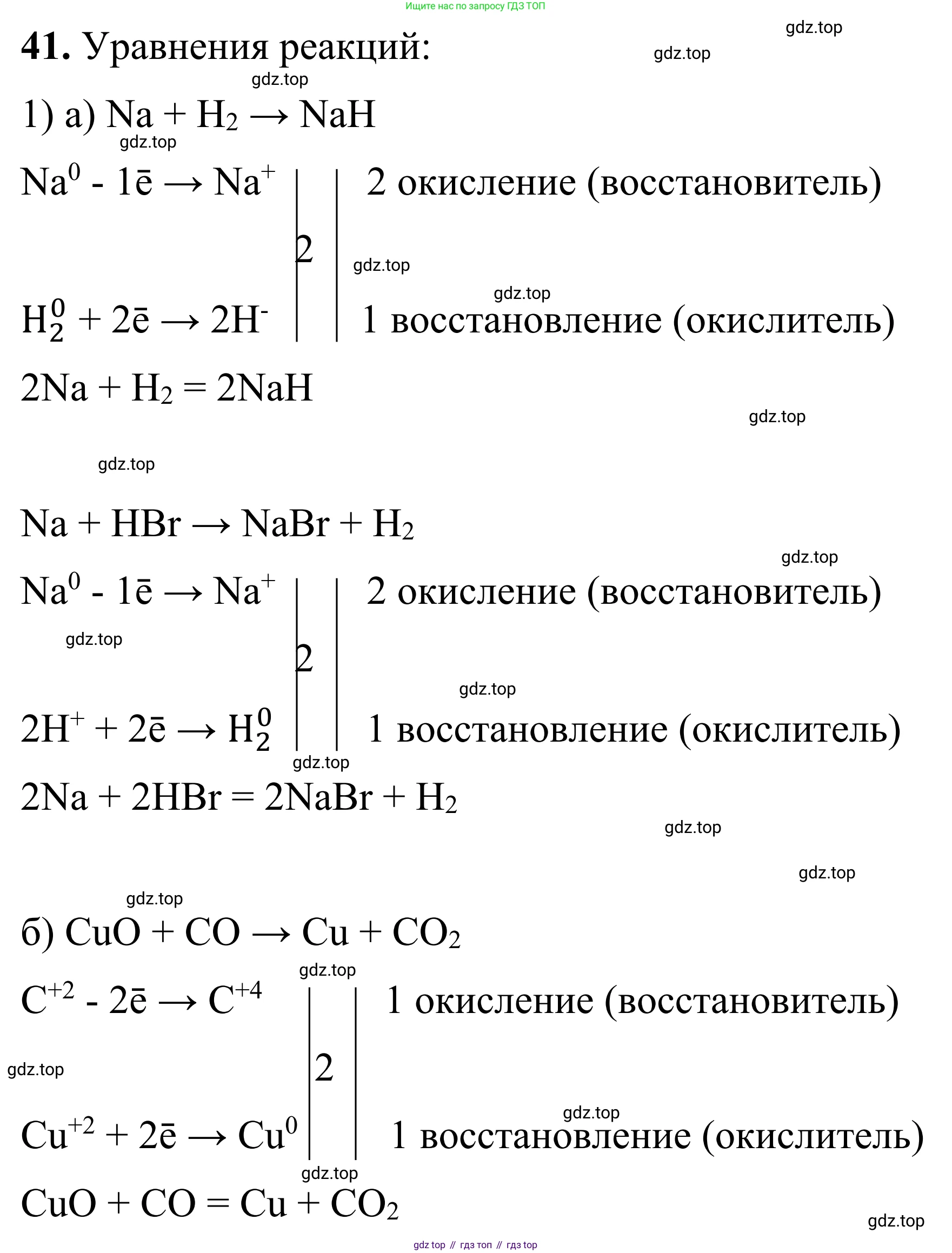
1) Возможна окислительно-восстановительная реакция между натрием и бромоводородной кислотой. Натрий, как активный металл, вытесняет водород из кислоты.
Уравнение реакции:
$2Na + 2HBr \rightarrow 2NaBr + H_2 \uparrow$
Схема электронного баланса:
$Na^0 - 1e^- \rightarrow Na^{+1}$ | 2 | окисление
$2H^{+1} + 2e^- \rightarrow H_2^0$ | 1 | восстановление
$Na$ (в степени окисления 0) является восстановителем, $HBr$ (за счет $H^{+1}$) является окислителем.
Ответ: восстановитель - $Na$, окислитель - $HBr$.
2) Возможна реакция ионного обмена между амфотерным гидроксидом цинка и бромоводородной кислотой с образованием соли и воды (реакция нейтрализации).
Молекулярное уравнение:
$Zn(OH)_2 + 2HBr \rightarrow ZnBr_2 + 2H_2O$
Полное ионное уравнение (гидроксид цинка - нерастворимое вещество):
$Zn(OH)_2 + 2H^+ + 2Br^- \rightarrow Zn^{2+} + 2Br^- + 2H_2O$
Сокращенное ионное уравнение:
$Zn(OH)_2 + 2H^+ \rightarrow Zn^{2+} + 2H_2O$
Ответ: $Zn(OH)_2 + 2H^+ \rightarrow Zn^{2+} + 2H_2O$.
б) CuO, HCl, Al(OH)₃, CO
1) Возможна окислительно-восстановительная реакция между оксидом меди(II) и угарным газом (оксидом углерода(II)) при нагревании. Угарный газ восстанавливает медь из ее оксида.
Уравнение реакции:
$CuO + CO \xrightarrow{t} Cu + CO_2$
Схема электронного баланса:
$C^{+2} - 2e^- \rightarrow C^{+4}$ | 1 | окисление
$Cu^{+2} + 2e^- \rightarrow Cu^0$ | 1 | восстановление
$CO$ (за счет $C^{+2}$) является восстановителем, $CuO$ (за счет $Cu^{+2}$) является окислителем.
Ответ: восстановитель - $CO$, окислитель - $CuO$.
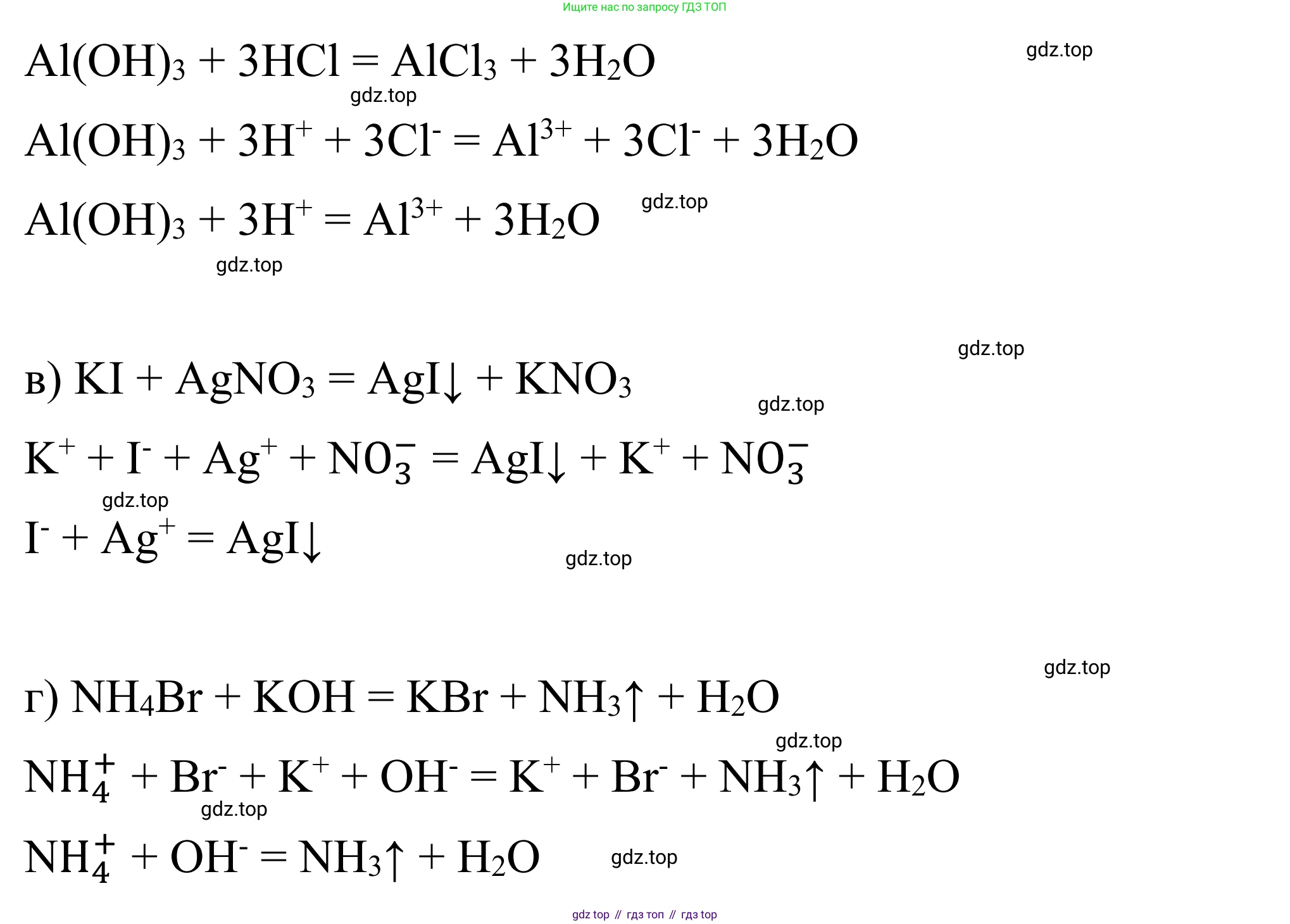
2) Возможна реакция ионного обмена между нерастворимым гидроксидом алюминия и соляной кислотой.
Молекулярное уравнение:
$Al(OH)_3 + 3HCl \rightarrow AlCl_3 + 3H_2O$
Полное ионное уравнение (гидроксид алюминия - нерастворимое вещество):
$Al(OH)_3 + 3H^+ + 3Cl^- \rightarrow Al^{3+} + 3Cl^- + 3H_2O$
Сокращенное ионное уравнение:
$Al(OH)_3 + 3H^+ \rightarrow Al^{3+} + 3H_2O$
Ответ: $Al(OH)_3 + 3H^+ \rightarrow Al^{3+} + 3H_2O$.
в) карбонат кальция, иодид калия, нитрат серебра, хлор
1) Возможна окислительно-восстановительная реакция между хлором и иодидом калия. Хлор, как более активный галоген, вытесняет иод из его соли.
Уравнение реакции:
$Cl_2 + 2KI \rightarrow 2KCl + I_2$
Схема электронного баланса:
$2I^{-1} - 2e^- \rightarrow I_2^0$ | 1 | окисление
$Cl_2^0 + 2e^- \rightarrow 2Cl^{-1}$ | 1 | восстановление
$KI$ (за счет $I^{-1}$) является восстановителем, $Cl_2$ является окислителем.
Ответ: восстановитель - $KI$, окислитель - $Cl_2$.
2) Возможна реакция ионного обмена между иодидом калия и нитратом серебра с образованием нерастворимого осадка иодида серебра.
Молекулярное уравнение:
$KI + AgNO_3 \rightarrow AgI \downarrow + KNO_3$
Полное ионное уравнение:
$K^+ + I^- + Ag^+ + NO_3^- \rightarrow AgI \downarrow + K^+ + NO_3^-$
Сокращенное ионное уравнение:
$Ag^+ + I^- \rightarrow AgI \downarrow$
Ответ: $Ag^+ + I^- \rightarrow AgI \downarrow$.
г) бромид аммония, гидроксид калия, перманганат калия, серная кислота
1) Возможна окислительно-восстановительная реакция между перманганатом калия (сильный окислитель), бромидом аммония (восстановитель) в кислой среде (серная кислота).
Уравнение реакции:
$2KMnO_4 + 10NH_4Br + 8H_2SO_4 \rightarrow 2MnSO_4 + 5Br_2 + K_2SO_4 + 5(NH_4)_2SO_4 + 8H_2O$
Схема электронного баланса:
$2Br^{-1} - 2e^- \rightarrow Br_2^0$ | 5 | окисление
$Mn^{+7} + 5e^- \rightarrow Mn^{+2}$ | 2 | восстановление
$NH_4Br$ (за счет $Br^{-1}$) является восстановителем, $KMnO_4$ (за счет $Mn^{+7}$) является окислителем.
Ответ: восстановитель - $NH_4Br$, окислитель - $KMnO_4$.
2) Возможна реакция ионного обмена между солью аммония (бромид аммония) и щелочью (гидроксид калия) с выделением газообразного аммиака.
Молекулярное уравнение:
$NH_4Br + KOH \rightarrow KBr + NH_3 \uparrow + H_2O$
Полное ионное уравнение:
$NH_4^+ + Br^- + K^+ + OH^- \rightarrow K^+ + Br^- + NH_3 \uparrow + H_2O$
Сокращенное ионное уравнение:
$NH_4^+ + OH^- \rightarrow NH_3 \uparrow + H_2O$
Ответ: $NH_4^+ + OH^- \rightarrow NH_3 \uparrow + H_2O$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 41 расположенного на странице 44 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №41 (с. 44), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















