Номер 33, страница 66 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2025
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
7. Кислород, сера и их соединения. Упражнения и задачи для самостоятельного решения - номер 33, страница 66.
№33 (с. 66)
Условие. №33 (с. 66)
скриншот условия

33. Закончите уравнения возможных реакций. Какие из них являются реакциями ионного обмена? Уравнения этих реакций запишите в молекулярной, полной и сокращённой ионной форме.
а) $H_2S + O_2(\text{изб.}) \rightarrow$
б) $H_2S(\text{изб.}) + KOH \rightarrow$
в) $H_2S + KOH(\text{изб.}) \rightarrow$
г) $Na_2S + HCl \rightarrow$
д) $CuS + O_2 \rightarrow$
е) $ZnS + NaOH \rightarrow$
ж) $K_2S + NaOH \rightarrow$
з) $H_2S + Pb(NO_3)_2 \rightarrow$
Решение. №33 (с. 66)
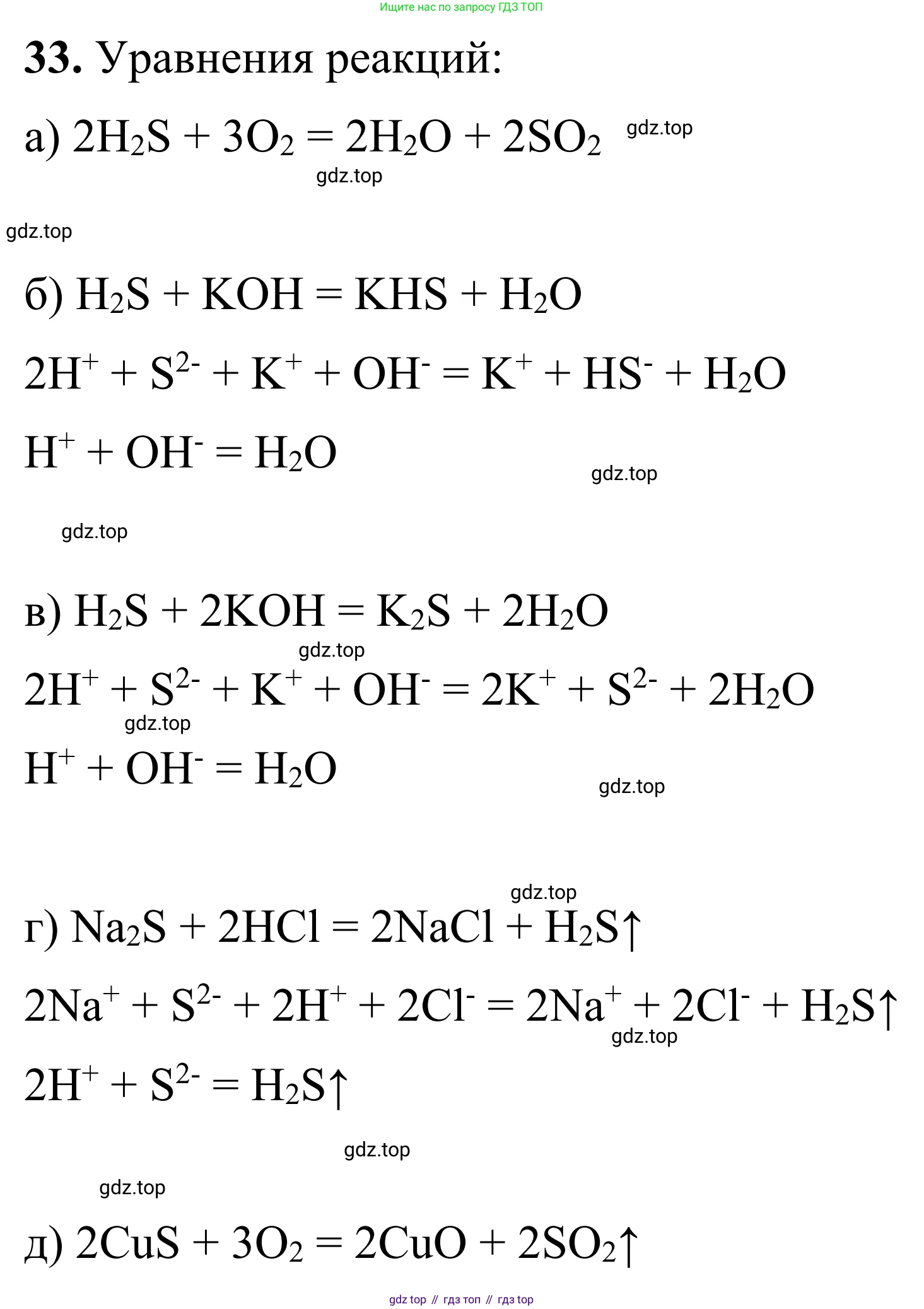

Решение 2. №33 (с. 66)
а) H₂S + O₂(изб.) →
Это окислительно-восстановительная реакция горения сероводорода в избытке кислорода. Продуктами реакции являются оксид серы(IV) и вода. Данная реакция не является реакцией ионного обмена, так как происходит изменение степеней окисления элементов.
Молекулярное уравнение: $2H_2S + 3O_2 \rightarrow 2SO_2 + 2H_2O$.
Ответ: $2H_2S + 3O_2 \rightarrow 2SO_2 + 2H_2O$.
б) H₂S(изб.) + KOH →
Это реакция ионного обмена. При взаимодействии избытка слабой двухосновной сероводородной кислоты со щелочью образуется кислая соль (гидросульфид калия) и вода.
Молекулярное уравнение: $H_2S + KOH \rightarrow KHS + H_2O$.
Полное ионное уравнение (сероводород – слабая кислота, пишется в молекулярном виде): $H_2S + K^+ + OH^- \rightarrow K^+ + HS^- + H_2O$.
Сокращенное ионное уравнение: $H_2S + OH^- \rightarrow HS^- + H_2O$.
Ответ: Молекулярное уравнение: $H_2S + KOH \rightarrow KHS + H_2O$. Полное ионное уравнение: $H_2S + K^+ + OH^- \rightarrow K^+ + HS^- + H_2O$. Сокращенное ионное уравнение: $H_2S + OH^- \rightarrow HS^- + H_2O$.
в) H₂S + KOH(изб.) →
Это реакция ионного обмена. При взаимодействии сероводородной кислоты с избытком щелочи образуется средняя соль (сульфид калия) и вода.
Молекулярное уравнение: $H_2S + 2KOH \rightarrow K_2S + 2H_2O$.
Полное ионное уравнение: $H_2S + 2K^+ + 2OH^- \rightarrow 2K^+ + S^{2-} + 2H_2O$.
Сокращенное ионное уравнение: $H_2S + 2OH^- \rightarrow S^{2-} + 2H_2O$.
Ответ: Молекулярное уравнение: $H_2S + 2KOH \rightarrow K_2S + 2H_2O$. Полное ионное уравнение: $H_2S + 2K^+ + 2OH^- \rightarrow 2K^+ + S^{2-} + 2H_2O$. Сокращенное ионное уравнение: $H_2S + 2OH^- \rightarrow S^{2-} + 2H_2O$.
г) Na₂S + HCl →
Это реакция ионного обмена. Сильная соляная кислота вытесняет слабую сероводородную кислоту из ее соли. Образуется газообразный сероводород.
Молекулярное уравнение: $Na_2S + 2HCl \rightarrow 2NaCl + H_2S\uparrow$.
Полное ионное уравнение: $2Na^+ + S^{2-} + 2H^+ + 2Cl^- \rightarrow 2Na^+ + 2Cl^- + H_2S\uparrow$.
Сокращенное ионное уравнение: $S^{2-} + 2H^+ \rightarrow H_2S\uparrow$.
Ответ: Молекулярное уравнение: $Na_2S + 2HCl \rightarrow 2NaCl + H_2S\uparrow$. Полное ионное уравнение: $2Na^+ + S^{2-} + 2H^+ + 2Cl^- \rightarrow 2Na^+ + 2Cl^- + H_2S\uparrow$. Сокращенное ионное уравнение: $S^{2-} + 2H^+ \rightarrow H_2S\uparrow$.
д) CuS + O₂ →
Это окислительно-восстановительная реакция (обжиг сульфида меди). Реакция протекает при нагревании. Данная реакция не является реакцией ионного обмена.
Молекулярное уравнение: $2CuS + 3O_2 \xrightarrow{t} 2CuO + 2SO_2$.
Ответ: $2CuS + 3O_2 \xrightarrow{t} 2CuO + 2SO_2$.
е) ZnS + NaOH →
Реакция не протекает. Реакции ионного обмена между нерастворимой солью и растворимым реагентом идут только в том случае, если образующийся осадок значительно менее растворим, чем исходный. Произведение растворимости сульфида цинка ($ПР(ZnS) \approx 2.5 \cdot 10^{-22}$) меньше, чем у гидроксида цинка ($ПР(Zn(OH)_2) \approx 3 \cdot 10^{-17}$), поэтому равновесие смещено влево.
Ответ: Реакция не идет.
ж) K₂S + NaOH →
Реакция не протекает. В растворе находятся ионы $K^+, S^{2-}, Na^+, OH^-$. Все возможные продукты реакции (KOH, Na₂S) являются сильными электролитами и хорошо растворимы в воде. Реакция ионного обмена не идет, так как не образуется осадок, газ или слабый электролит.
Ответ: Реакция не идет.
з) H₂S + Pb(NO₃)₂ →
Это реакция ионного обмена. При пропускании сероводорода через раствор нитрата свинца(II) образуется черный осадок сульфида свинца(II).
Молекулярное уравнение: $H_2S + Pb(NO_3)_2 \rightarrow PbS\downarrow + 2HNO_3$.
Полное ионное уравнение: $H_2S + Pb^{2+} + 2NO_3^- \rightarrow PbS\downarrow + 2H^+ + 2NO_3^-$.
Сокращенное ионное уравнение: $H_2S + Pb^{2+} \rightarrow PbS\downarrow + 2H^+$.
Ответ: Молекулярное уравнение: $H_2S + Pb(NO_3)_2 \rightarrow PbS\downarrow + 2HNO_3$. Полное ионное уравнение: $H_2S + Pb^{2+} + 2NO_3^- \rightarrow PbS\downarrow + 2H^+ + 2NO_3^-$. Сокращенное ионное уравнение: $H_2S + Pb^{2+} \rightarrow PbS\downarrow + 2H^+$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 33 расположенного на странице 66 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №33 (с. 66), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















