Номер 40, страница 67 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
7. Кислород, сера и их соединения. Упражнения и задачи для самостоятельного решения - номер 40, страница 67.
№40 (с. 67)
Условие. №40 (с. 67)
скриншот условия

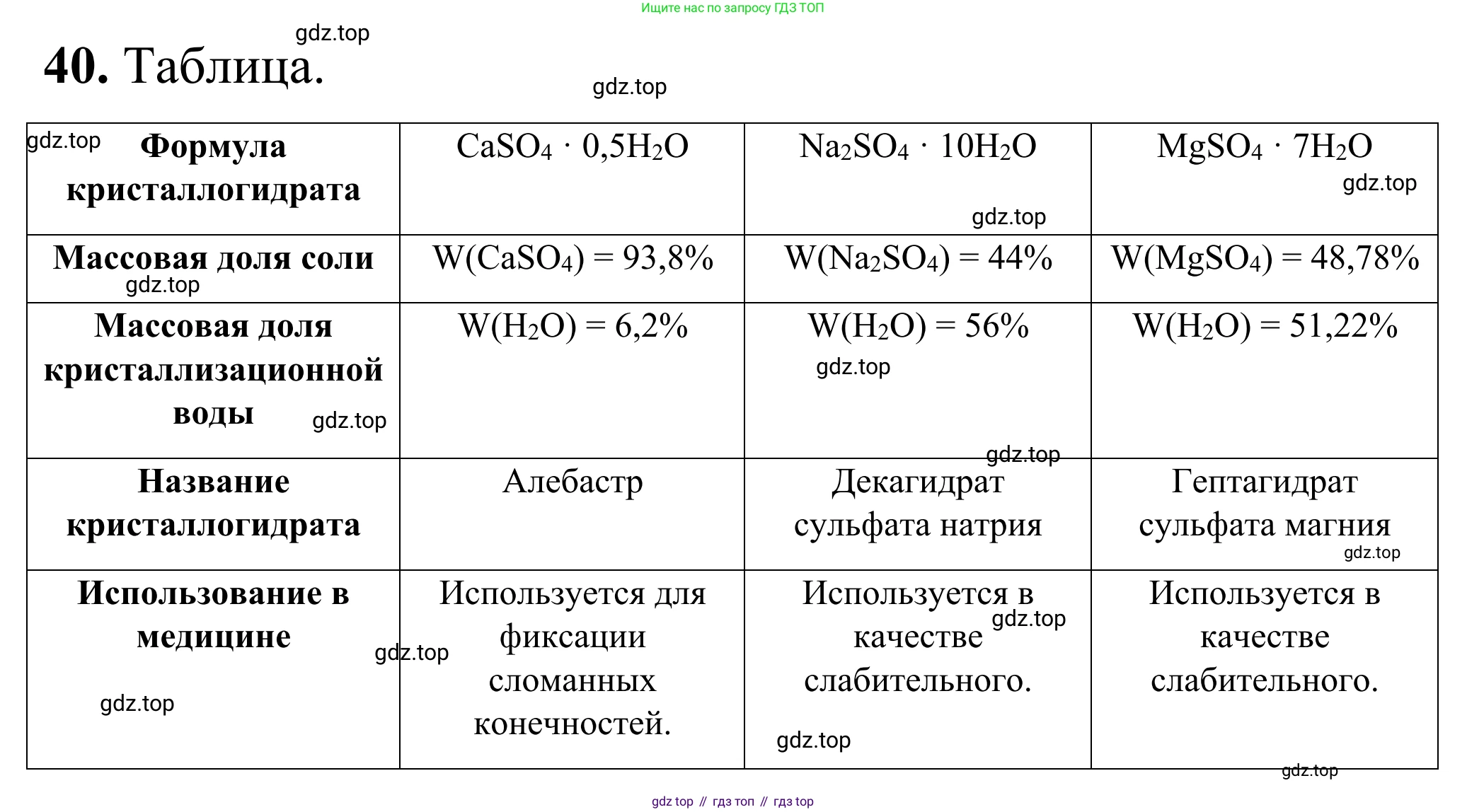
40. Заполните в тетради таблицу. Расчёты проведите, используя только данные таблицы.
Формула кристаллогидрата
$CaSO_4 \cdot 0.5H_2O$
Массовая доля соли
$w(Na_2SO_4) = 44 \%$
Массовая доля кристаллизационной воды
Название кристаллогидрата
Гептагидрат сульфата магния
Использование в медицине
Решение. №40 (с. 67)
Решение 2. №40 (с. 67)
Расчёты для столбца 1
Массовая доля соли и Массовая доля кристаллизационной воды
Дано:
Формула кристаллогидрата: $CaSO_4 \cdot 0,5H_2O$
Найти:
$w(CaSO_4)$ - массовую долю соли
$w(H_2O)$ - массовую долю кристаллизационной воды
Решение:
1. Рассчитаем молярные массы безводной соли, воды и кристаллогидрата, используя относительные атомные массы элементов: $Ar(Ca) = 40$, $Ar(S) = 32$, $Ar(O) = 16$, $Ar(H) = 1$.
Молярная масса сульфата кальция $CaSO_4$:
$M(CaSO_4) = Ar(Ca) + Ar(S) + 4 \cdot Ar(O) = 40 + 32 + 4 \cdot 16 = 136 \text{ г/моль}$
Молярная масса воды $H_2O$:
$M(H_2O) = 2 \cdot Ar(H) + Ar(O) = 2 \cdot 1 + 16 = 18 \text{ г/моль}$
Молярная масса кристаллогидрата $CaSO_4 \cdot 0,5H_2O$:
$M(CaSO_4 \cdot 0,5H_2O) = M(CaSO_4) + 0,5 \cdot M(H_2O) = 136 + 0,5 \cdot 18 = 136 + 9 = 145 \text{ г/моль}$
2. Рассчитаем массовые доли соли и воды в кристаллогидрате.
Массовая доля соли $w(CaSO_4)$:
$w(CaSO_4) = \frac{M(CaSO_4)}{M(CaSO_4 \cdot 0,5H_2O)} = \frac{136}{145} \approx 0,9379$ или $93,79\%$
Массовая доля воды $w(H_2O)$:
$w(H_2O) = \frac{0,5 \cdot M(H_2O)}{M(CaSO_4 \cdot 0,5H_2O)} = \frac{9}{145} \approx 0,0621$ или $6,21\%$
Проверка: $93,79\% + 6,21\% = 100\%$
Ответ: Массовая доля соли $w(CaSO_4) = 93,79\%$. Массовая доля кристаллизационной воды $w(H_2O) = 6,21\%$.
Название кристаллогидрата
Полугидрат сульфата кальция, также известный как жжёный гипс или алебастр.
Ответ: Полугидрат сульфата кальция (жжёный гипс, алебастр).
Использование в медицине
Применяется в травматологии для наложения гипсовых повязок с целью фиксации костных отломков при переломах.
Ответ: Наложение гипсовых повязок в травматологии.
Расчёты для столбца 2
Формула кристаллогидрата
Дано:
Кристаллогидрат сульфата натрия $Na_2SO_4 \cdot nH_2O$
$w(Na_2SO_4) = 44\% = 0,44$
Найти:
Формулу кристаллогидрата (значение $n$).
Решение:
1. Найдем массовую долю воды в кристаллогидрате:
$w(H_2O) = 100\% - w(Na_2SO_4) = 100\% - 44\% = 56\%$ или $0,56$
2. Рассчитаем молярные массы безводной соли и воды, используя относительные атомные массы: $Ar(Na) = 23$, $Ar(S) = 32$, $Ar(O) = 16$, $Ar(H) = 1$.
$M(Na_2SO_4) = 2 \cdot Ar(Na) + Ar(S) + 4 \cdot Ar(O) = 2 \cdot 23 + 32 + 4 \cdot 16 = 142 \text{ г/моль}$
$M(H_2O) = 18 \text{ г/моль}$
3. Соотношение массовых долей соли и воды равно соотношению их масс в составе кристаллогидрата. Обозначим формулу как $Na_2SO_4 \cdot nH_2O$.
$\frac{w(Na_2SO_4)}{w(H_2O)} = \frac{M(Na_2SO_4)}{n \cdot M(H_2O)}$
Подставим известные значения и решим уравнение относительно $n$:
$\frac{0,44}{0,56} = \frac{142}{n \cdot 18}$
$n = \frac{142 \cdot 0,56}{0,44 \cdot 18} = \frac{79,52}{7,92} \approx 10,04$
Поскольку число молекул воды должно быть целым, принимаем $n = 10$.
Следовательно, формула кристаллогидрата $Na_2SO_4 \cdot 10H_2O$.
Ответ: $Na_2SO_4 \cdot 10H_2O$.
Массовая доля кристаллизационной воды
Массовая доля воды была найдена в предыдущем расчёте.
Ответ: $w(H_2O) = 56\%$.
Название кристаллогидрата
Декагидрат сульфата натрия, также известный как глауберова соль или мирабилит.
Ответ: Декагидрат сульфата натрия (глауберова соль).
Использование в медицине
Применяется в качестве солевого слабительного средства.
Ответ: Слабительное средство.
Расчёты для столбца 3
Формула кристаллогидрата
Название "гептагидрат сульфата магния" указывает на состав: одна формульная единица сульфата магния ($MgSO_4$) и семь ("гепта") молекул воды ($H_2O$).
Ответ: $MgSO_4 \cdot 7H_2O$.
Массовая доля соли и Массовая доля кристаллизационной воды
Дано:
Формула кристаллогидрата: $MgSO_4 \cdot 7H_2O$
Найти:
$w(MgSO_4)$ - массовую долю соли
$w(H_2O)$ - массовую долю кристаллизационной воды
Решение:
1. Рассчитаем молярные массы безводной соли, воды и кристаллогидрата, используя относительные атомные массы: $Ar(Mg) = 24$, $Ar(S) = 32$, $Ar(O) = 16$, $Ar(H) = 1$.
Молярная масса сульфата магния $MgSO_4$:
$M(MgSO_4) = Ar(Mg) + Ar(S) + 4 \cdot Ar(O) = 24 + 32 + 4 \cdot 16 = 120 \text{ г/моль}$
Молярная масса воды $M(H_2O) = 18 \text{ г/моль}$.
Молярная масса кристаллогидрата $MgSO_4 \cdot 7H_2O$:
$M(MgSO_4 \cdot 7H_2O) = M(MgSO_4) + 7 \cdot M(H_2O) = 120 + 7 \cdot 18 = 120 + 126 = 246 \text{ г/моль}$
2. Рассчитаем массовые доли соли и воды в кристаллогидрате.
Массовая доля соли $w(MgSO_4)$:
$w(MgSO_4) = \frac{M(MgSO_4)}{M(MgSO_4 \cdot 7H_2O)} = \frac{120}{246} \approx 0,4878$ или $48,78\%$
Массовая доля воды $w(H_2O)$:
$w(H_2O) = \frac{7 \cdot M(H_2O)}{M(MgSO_4 \cdot 7H_2O)} = \frac{126}{246} \approx 0,5122$ или $51,22\%$
Проверка: $48,78\% + 51,22\% = 100\%$
Ответ: Массовая доля соли $w(MgSO_4) = 48,78\%$. Массовая доля кристаллизационной воды $w(H_2O) = 51,22\%$.
Использование в медицине
Применяется как слабительное, желчегонное и спазмолитическое средство. Также известен как горькая или английская соль.
Ответ: Слабительное и желчегонное средство.
Итоговая заполненная таблица
| Столбец 1 | Столбец 2 | Столбец 3 | |
|---|---|---|---|
| Формула кристаллогидрата | $CaSO_4 \cdot 0,5H_2O$ | $Na_2SO_4 \cdot 10H_2O$ | $MgSO_4 \cdot 7H_2O$ |
| Массовая доля соли | $w(CaSO_4) = 93,79\%$ | $w(Na_2SO_4) = 44\%$ | $w(MgSO_4) = 48,78\%$ |
| Массовая доля кристаллизационной воды | $w(H_2O) = 6,21\%$ | $w(H_2O) = 56\%$ | $w(H_2O) = 51,22\%$ |
| Название кристаллогидрата | Полугидрат сульфата кальция (жжёный гипс, алебастр) | Декагидрат сульфата натрия (глауберова соль) | Гептагидрат сульфата магния (горькая соль) |
| Использование в медицине | Наложение гипсовых повязок в травматологии | Слабительное средство | Слабительное и желчегонное средство |
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 40 расположенного на странице 67 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №40 (с. 67), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















