Номер 41, страница 67 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2025
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
7. Кислород, сера и их соединения. Упражнения и задачи для самостоятельного решения - номер 41, страница 67.
№41 (с. 67)
Условие. №41 (с. 67)
скриншот условия

41. Какую массу декагидрата сульфата натрия необходимо добавить к 100 мл 8 %-ного раствора сульфата натрия (плотность 1,07 г/мл), чтобы удвоить массовую долю соли в растворе?
Решение. №41 (с. 67)

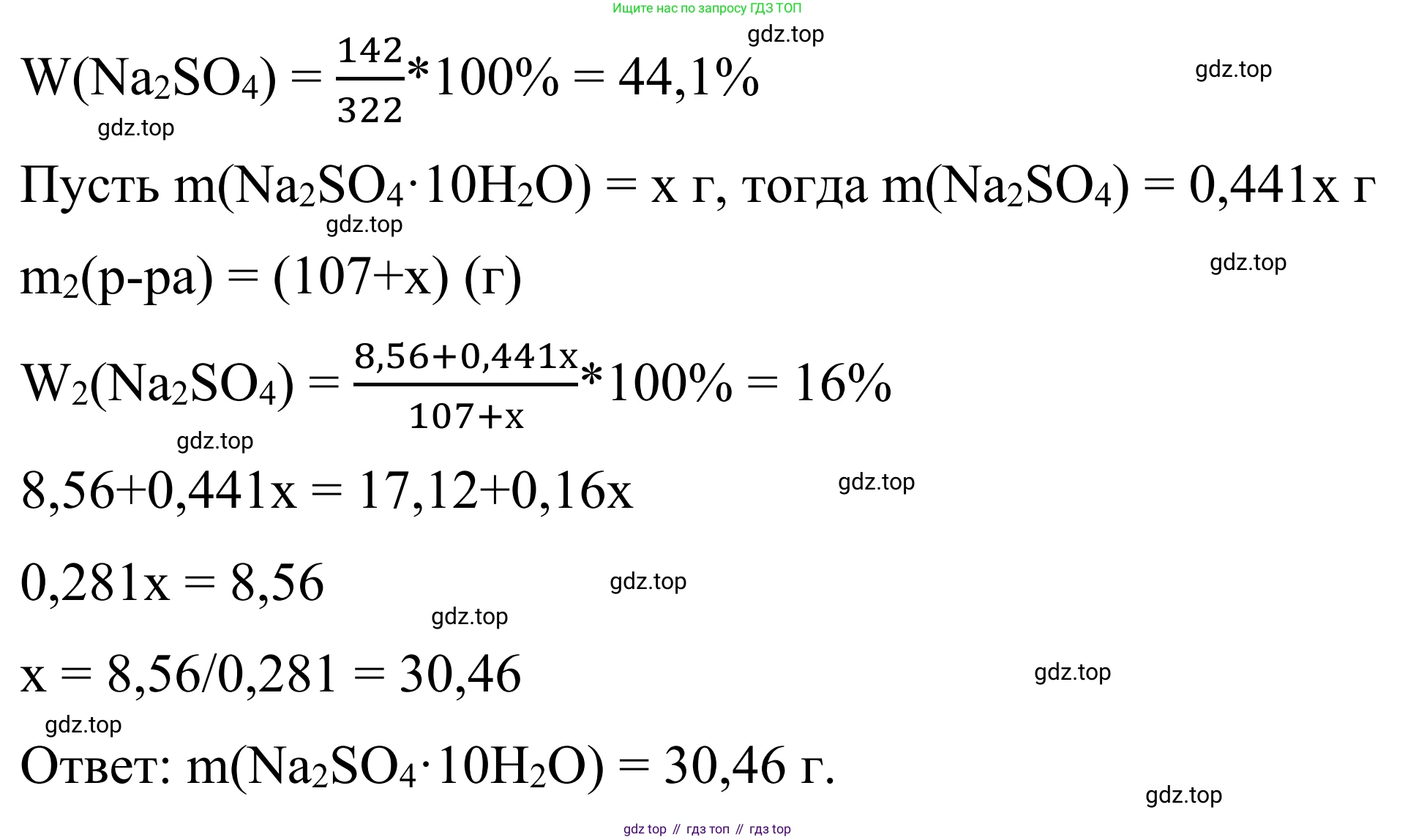
Решение 2. №41 (с. 67)
Дано:
$\omega_1(Na_2SO_4) = 8\% = 0.08$
$\rho_1(\text{раствора}) = 1.07 \text{ г/мл} = 1070 \text{ кг/м}^3$
Найти:
$m(Na_2SO_4 \cdot 10H_2O)$ - ?
Решение:
1. Найдем массу исходного 8%-ного раствора сульфата натрия. Масса раствора ($m_{р-ра1}$) вычисляется по формуле:
$m = \rho \cdot V$
$m_{р-ра1} = \rho_1 \cdot V_1 = 1.07 \text{ г/мл} \cdot 100 \text{ мл} = 107 \text{ г}$
2. Рассчитаем массу безводного сульфата натрия ($Na_2SO_4$) в исходном растворе. Масса растворенного вещества ($m_{в-ва}$) находится как произведение массы раствора на его массовую долю ($\omega$):
$m_{в-ва} = m_{р-ра} \cdot \omega$
$m_1(Na_2SO_4) = m_{р-ра1} \cdot \omega_1(Na_2SO_4) = 107 \text{ г} \cdot 0.08 = 8.56 \text{ г}$
3. По условию задачи, массовую долю соли в растворе необходимо удвоить. Таким образом, конечная массовая доля сульфата натрия ($\omega_2$) будет равна:
$\omega_2(Na_2SO_4) = 2 \cdot \omega_1(Na_2SO_4) = 2 \cdot 8\% = 16\% \text{ или } 0.16$
4. При добавлении декагидрата сульфата натрия ($Na_2SO_4 \cdot 10H_2O$) в раствор увеличивается как масса растворенного вещества ($Na_2SO_4$), так и общая масса раствора (за счет добавления и соли, и воды, входящей в состав кристаллогидрата).
Рассчитаем молярные массы сульфата натрия и его декагидрата:
$M(Na_2SO_4) = 2 \cdot M(Na) + M(S) + 4 \cdot M(O) = 2 \cdot 23 + 32 + 4 \cdot 16 = 142 \text{ г/моль}$
$M(Na_2SO_4 \cdot 10H_2O) = M(Na_2SO_4) + 10 \cdot M(H_2O) = 142 + 10 \cdot (2 \cdot 1 + 16) = 142 + 180 = 322 \text{ г/моль}$
5. Найдем массовую долю безводной соли в кристаллогидрате:
$\omega(Na_2SO_4 \text{ в } Na_2SO_4 \cdot 10H_2O) = \frac{M(Na_2SO_4)}{M(Na_2SO_4 \cdot 10H_2O)} = \frac{142}{322}$
6. Обозначим массу добавленного декагидрата сульфата натрия как $x$ (в граммах). Тогда масса безводного сульфата натрия, которую мы добавили в раствор, составляет $x \cdot \frac{142}{322}$ г.
7. Составим уравнение для массовой доли соли в конечном растворе. Массовая доля равна отношению массы растворенного вещества к массе всего раствора.
Масса растворенного вещества в конечном растворе:
$m_2(Na_2SO_4) = m_1(Na_2SO_4) + m_{доб}(Na_2SO_4) = 8.56 + x \cdot \frac{142}{322}$
Масса конечного раствора:
$m_{р-ра2} = m_{р-ра1} + x = 107 + x$
Подставим эти выражения в формулу для конечной массовой доли:
$\omega_2(Na_2SO_4) = \frac{m_2(Na_2SO_4)}{m_{р-ра2}}$
$0.16 = \frac{8.56 + x \cdot \frac{142}{322}}{107 + x}$
8. Решим полученное уравнение относительно $x$:
$0.16 \cdot (107 + x) = 8.56 + \frac{142}{322}x$
$17.12 + 0.16x = 8.56 + \frac{142}{322}x$
$17.12 - 8.56 = (\frac{142}{322} - 0.16)x$
$8.56 = (\frac{142}{322} - \frac{0.16 \cdot 322}{322})x$
$8.56 = (\frac{142 - 51.52}{322})x$
$8.56 = \frac{90.48}{322}x$
$x = \frac{8.56 \cdot 322}{90.48} = \frac{2756.32}{90.48} \approx 30.46 \text{ г}$
Ответ:
необходимо добавить 30,46 г декагидрата сульфата натрия.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 41 расположенного на странице 67 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №41 (с. 67), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















