Номер 47, страница 107 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2025
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
10. Металлы. Упражнения и задачи для самостоятельного решения - номер 47, страница 107.
№47 (с. 107)
Условие. №47 (с. 107)
скриншот условия


47. Закончите уравнения химических реакций, иллюстрирующих свойства алюминия, оксида алюминия и гидроксида алюминия.
а) $Al + H_2SO_4 \rightarrow$
б) $Al + KOH (p-p) \rightarrow$
в) $Al + KOH (расплав) \rightarrow$
г) $Al_2O_3 + HCl \rightarrow$
д) $Al_2O_3 + SO_3 \rightarrow$
е) $Al_2O_3 + Na_2O \rightarrow$
ж) $Al_2O_3 + NaOH(p-p) \rightarrow$
з) $Al_2O_3 + NaOH(расплав) \rightarrow$
и) $Al(OH)_3 + HBr \rightarrow$
к) $Al(OH)_3 + Ba(OH)_2(p-p) \rightarrow$
л) $Al(OH)_3 + Ba(OH)_2(расплав) \rightarrow$
Решение. №47 (с. 107)

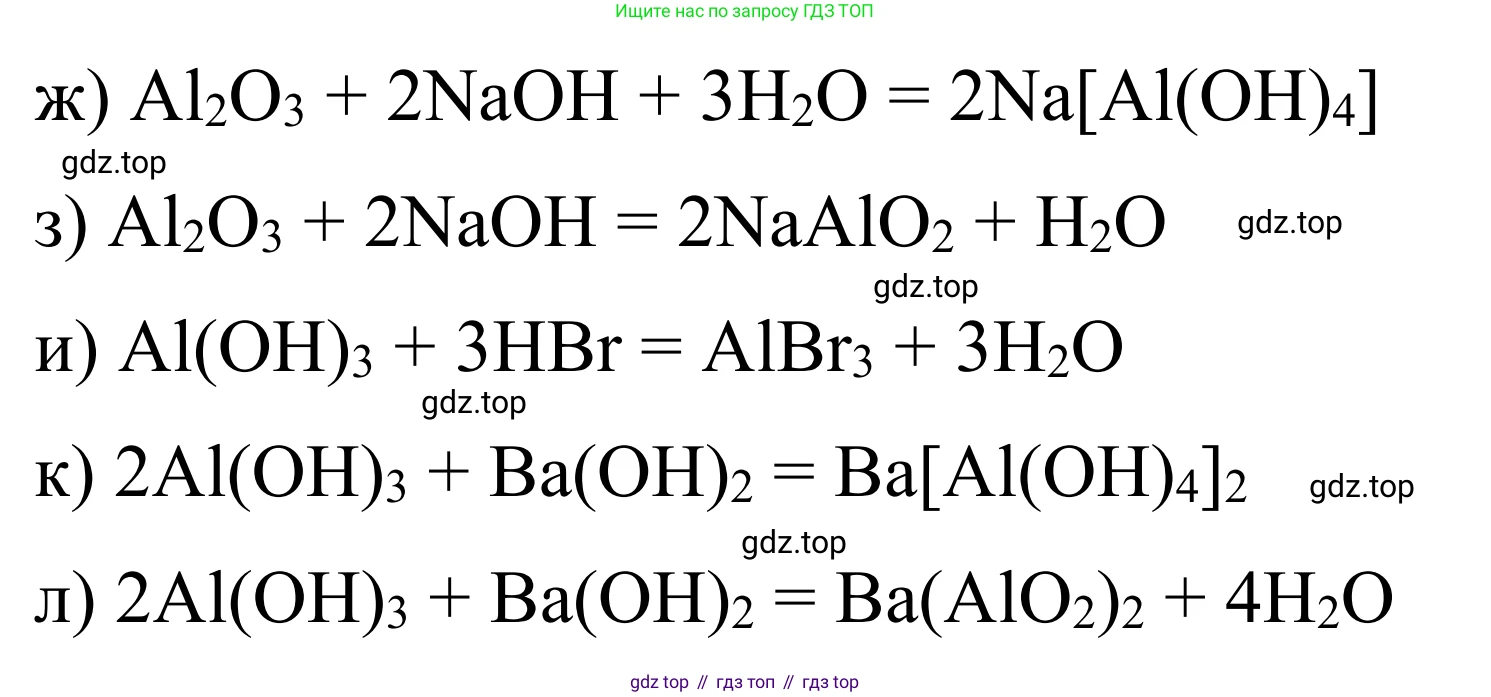
Решение 2. №47 (с. 107)
а) Алюминий является активным металлом, стоящим в ряду активности металлов до водорода, поэтому он реагирует с разбавленной серной кислотой, вытесняя водород и образуя сульфат алюминия.
Ответ: $2Al + 3H_2SO_4 \rightarrow Al_2(SO_4)_3 + 3H_2\uparrow$
б) Алюминий проявляет амфотерные свойства, реагируя с водным раствором щёлочи. При этом образуется комплексная соль — тетрагидроксоалюминат калия — и выделяется водород. В реакции также участвует вода.
Ответ: $2Al + 2KOH + 6H_2O \rightarrow 2K[Al(OH)_4] + 3H_2\uparrow$
в) При сплавлении с щёлочью алюминий также проявляет амфотерные свойства. В отсутствие воды образуется средняя соль — ортоалюминат калия — и выделяется водород.
Ответ: $2Al + 6KOH \xrightarrow{t^\circ} 2K_3AlO_3 + 3H_2\uparrow$
г) Оксид алюминия $Al_2O_3$ является амфотерным оксидом. Он реагирует с сильными кислотами, проявляя свои основные свойства, с образованием соли и воды.
Ответ: $Al_2O_3 + 6HCl \rightarrow 2AlCl_3 + 3H_2O$
д) В реакции с кислотным оксидом, таким как оксид серы(VI), амфотерный оксид алюминия проявляет основные свойства. Реакция протекает при нагревании с образованием соли — сульфата алюминия.
Ответ: $Al_2O_3 + 3SO_3 \xrightarrow{t^\circ} Al_2(SO_4)_3$
е) При взаимодействии с основным оксидом, таким как оксид натрия, оксид алюминия проявляет кислотные свойства. Реакция сплавления приводит к образованию метаалюмината натрия.
Ответ: $Al_2O_3 + Na_2O \xrightarrow{t^\circ} 2NaAlO_2$
ж) В водном растворе щёлочи оксид алюминия проявляет кислотные свойства, образуя комплексную соль — тетрагидроксоалюминат натрия.
Ответ: $Al_2O_3 + 2NaOH + 3H_2O \rightarrow 2Na[Al(OH)_4]$
з) При сплавлении со щёлочью оксид алюминия также проявляет кислотные свойства, образуя метаалюминат натрия и воду.
Ответ: $Al_2O_3 + 2NaOH \xrightarrow{t^\circ} 2NaAlO_2 + H_2O$
и) Гидроксид алюминия $Al(OH)_3$ — амфотерное основание, которое реагирует с кислотами с образованием соли и воды, проявляя свои основные свойства.
Ответ: $Al(OH)_3 + 3HBr \rightarrow AlBr_3 + 3H_2O$
к) Проявляя кислотные свойства, гидроксид алюминия реагирует с водными растворами щелочей, образуя комплексные соли. С гидроксидом бария образуется тетрагидроксоалюминат бария.
Ответ: $2Al(OH)_3 + Ba(OH)_2 \rightarrow Ba[Al(OH)_4]_2$
л) При сплавлении с гидроксидом бария гидроксид алюминия проявляет кислотные свойства, разлагаясь с образованием метаалюмината бария и воды.
Ответ: $2Al(OH)_3 + Ba(OH)_2 \xrightarrow{t^\circ} Ba(AlO_2)_2 + 4H_2O$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 47 расположенного на странице 107 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №47 (с. 107), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















