Номер 55, страница 108 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2025
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
10. Металлы. Упражнения и задачи для самостоятельного решения - номер 55, страница 108.
№55 (с. 108)
Условие. №55 (с. 108)
скриншот условия

55. Составьте уравнения химических реакций, соответствующих следующим превращениям:
a) цинк -> оксид цинка -> сульфат цинка -> хлорид цинка -> нитрат цинка -> сульфид цинка -> оксид цинка -> цинкат калия
б) оксид алюминия -> тетрагидроксоалюминат калия -> хлорид алюминия -> гидроксид алюминия -> гексагидроксоалюминат калия
в) хром -> хлорид хрома(II) -> хлорид хрома(III) -> гексагидроксохромат(III) калия -> хромат калия -> дихромат калия -> оксид хрома(VI)
г) сульфид железа(II) -> $X_1$ -> оксид железа(III) -> $X_2$ -> сульфид железа(II)
д) хлорид железа(II) -> $X_1$ -> $X_2$ -> $X_3$ -> $X_4$ -> $X_5$ -> хлорид железа(II) (все вещества содержат железо; в схеме только три ОВР — подряд).
Решение. №55 (с. 108)
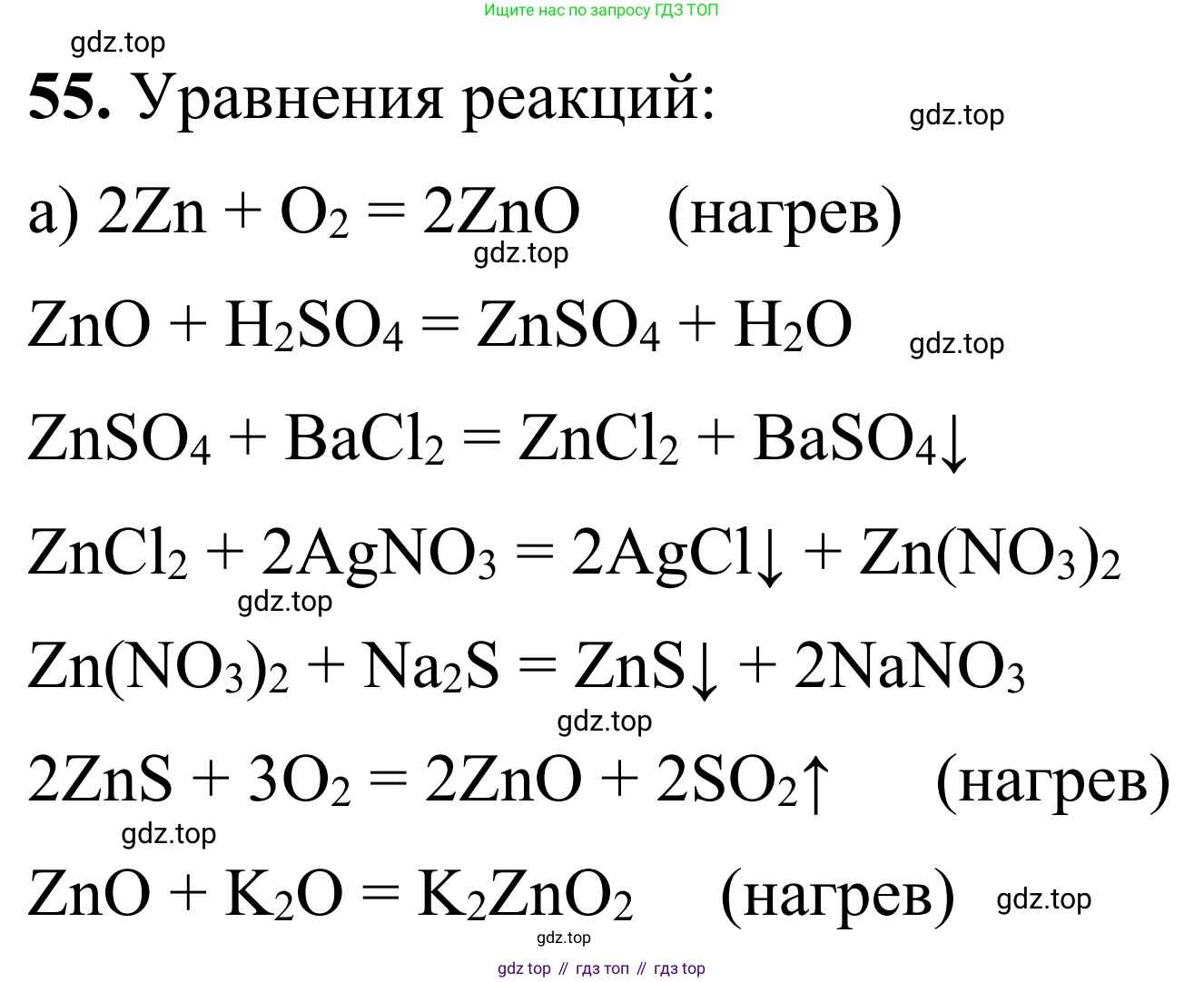

Решение 2. №55 (с. 108)
а) 1. Получение оксида цинка из цинка (реакция горения):
$2Zn + O_2 \xrightarrow{t} 2ZnO$
2. Получение сульфата цинка из оксида цинка (реакция с кислотой):
$ZnO + H_2SO_4 \rightarrow ZnSO_4 + H_2O$
3. Получение хлорида цинка из сульфата цинка (реакция ионного обмена с образованием осадка):
$ZnSO_4 + BaCl_2 \rightarrow ZnCl_2 + BaSO_4 \downarrow$
4. Получение нитрата цинка из хлорида цинка (реакция ионного обмена с образованием осадка):
$ZnCl_2 + 2AgNO_3 \rightarrow Zn(NO_3)_2 + 2AgCl \downarrow$
5. Получение сульфида цинка из нитрата цинка (реакция ионного обмена с образованием осадка):
$Zn(NO_3)_2 + Na_2S \rightarrow ZnS \downarrow + 2NaNO_3$
6. Получение оксида цинка из сульфида цинка (обжиг сульфида):
$2ZnS + 3O_2 \xrightarrow{t} 2ZnO + 2SO_2 \uparrow$
7. Получение цинката калия из оксида цинка (реакция сплавления с щелочью):
$ZnO + 2KOH \xrightarrow{t} K_2ZnO_2 + H_2O$
Ответ: уравнения реакций, соответствующие схеме превращений, приведены выше.
б) 1. Получение тетрагидроксоалюмината калия из оксида алюминия (реакция амфотерного оксида с раствором щелочи):
$Al_2O_3 + 2KOH + 3H_2O \rightarrow 2K[Al(OH)_4]$
2. Получение хлорида алюминия из тетрагидроксоалюмината калия (реакция с избытком сильной кислоты):
$K[Al(OH)_4] + 4HCl_{(изб.)} \rightarrow AlCl_3 + KCl + 4H_2O$
3. Получение гидроксида алюминия из хлорида алюминия (осаждение слабым основанием):
$AlCl_3 + 3NH_3 \cdot H_2O \rightarrow Al(OH)_3 \downarrow + 3NH_4Cl$
4. Получение гексагидроксоалюмината калия из гидроксида алюминия (реакция амфотерного гидроксида с концентрированным раствором щелочи):
$Al(OH)_3 + 3KOH_{(конц.)} \rightarrow K_3[Al(OH)_6]$
Ответ: уравнения реакций, соответствующие схеме превращений, приведены выше.
в) 1. Получение хлорида хрома(II) из хрома (реакция с соляной кислотой в инертной атмосфере):
$Cr + 2HCl \rightarrow CrCl_2 + H_2 \uparrow$
2. Получение хлорида хрома(III) из хлорида хрома(II) (окисление):
$2CrCl_2 + Cl_2 \rightarrow 2CrCl_3$
3. Получение гексагидроксохромата(III) калия из хлорида хрома(III) (реакция с избытком щелочи):
$CrCl_3 + 6KOH_{(изб.)} \rightarrow K_3[Cr(OH)_6] + 3KCl$
4. Получение хромата калия из гексагидроксохромата(III) калия (окисление в щелочной среде):
$2K_3[Cr(OH)_6] + 3H_2O_2 \rightarrow 2K_2CrO_4 + 2KOH + 8H_2O$
5. Получение дихромата калия из хромата калия (реакция в кислой среде):
$2K_2CrO_4 + H_2SO_4 \rightarrow K_2Cr_2O_7 + K_2SO_4 + H_2O$
6. Получение оксида хрома(VI) из дихромата калия (действие концентрированной серной кислоты):
$K_2Cr_2O_7 + 2H_2SO_{4(конц.)} \rightarrow 2CrO_3 \downarrow + 2KHSO_4 + H_2O$
Ответ: уравнения реакций, соответствующие схеме превращений, приведены выше.
г) В данной схеме неизвестными веществами являются $X_1$ — оксид железа(II) ($FeO$) и $X_2$ — железо ($Fe$).
1. $FeS \rightarrow X_1$: неполный обжиг сульфида железа(II):
$2FeS + 3O_2 \xrightarrow{t} 2FeO + 2SO_2 \uparrow$
2. $X_1 \rightarrow Fe_2O_3$: окисление оксида железа(II):
$4FeO + O_2 \xrightarrow{t} 2Fe_2O_3$
3. $Fe_2O_3 \rightarrow X_2$: восстановление оксида железа(III) до железа:
$Fe_2O_3 + 3CO \xrightarrow{t} 2Fe + 3CO_2 \uparrow$
4. $X_2 \rightarrow FeS$: получение сульфида железа(II) из простых веществ:
$Fe + S \xrightarrow{t} FeS$
Ответ: $X_1$ — оксид железа(II) ($FeO$), $X_2$ — железо ($Fe$). Уравнения реакций приведены выше.
д) В данной схеме три окислительно-восстановительные реакции (ОВР) должны идти подряд. Этому условию удовлетворяет следующая последовательность превращений, где ОВР являются реакции 1, 2 и 3. Неизвестные вещества:
$X_1$ — хлорид железа(III) ($FeCl_3$), $X_2$ — железо ($Fe$), $X_3$ — сульфид железа(II) ($FeS$), $X_4$ — сульфат железа(II) ($FeSO_4$), $X_5$ — гидроксид железа(II) ($Fe(OH)_2$).
1. (ОВР) $2FeCl_2 + Cl_2 \rightarrow 2FeCl_3$
2. (ОВР) $2FeCl_3 + 3Zn \rightarrow 2Fe + 3ZnCl_2$
3. (ОВР) $Fe + S \xrightarrow{t} FeS$
4. (Не ОВР) $FeS + H_2SO_4 \rightarrow FeSO_4 + H_2S \uparrow$
5. (Не ОВР) $FeSO_4 + 2NaOH \rightarrow Fe(OH)_2 \downarrow + Na_2SO_4$
6. (Не ОВР) $Fe(OH)_2 + 2HCl \rightarrow FeCl_2 + 2H_2O$
Ответ: $X_1$ — $FeCl_3$, $X_2$ — $Fe$, $X_3$ — $FeS$, $X_4$ — $FeSO_4$, $X_5$ — $Fe(OH)_2$. Соответствующие уравнения реакций приведены выше.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 55 расположенного на странице 108 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №55 (с. 108), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















