Номер 57, страница 109 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2025
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
10. Металлы. Упражнения и задачи для самостоятельного решения - номер 57, страница 109.
№57 (с. 109)
Условие. №57 (с. 109)
скриншот условия

57. При прокаливании 69,5 г кристаллогидрата сульфата железа(II) образуется 38 г безводной соли. Определите формулу кристаллогидрата.
Решение. №57 (с. 109)
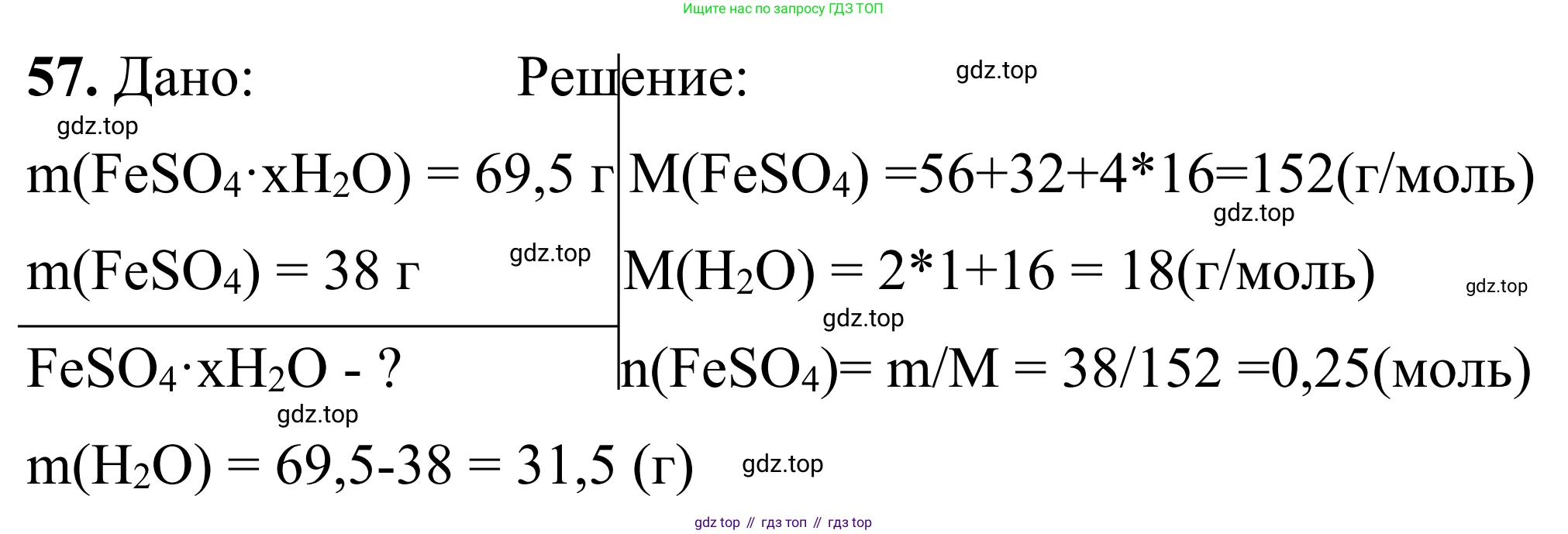

Решение 2. №57 (с. 109)
Дано:
масса кристаллогидрата сульфата железа(II) $m(FeSO_4 \cdot nH_2O) = 69,5$ г
масса безводной соли сульфата железа(II) $m(FeSO_4) = 38$ г
$m(FeSO_4 \cdot nH_2O) = 0,0695$ кг
$m(FeSO_4) = 0,038$ кг
Найти:
Формулу кристаллогидрата - $n$
Решение:
Общая формула кристаллогидрата сульфата железа(II) - $FeSO_4 \cdot nH_2O$. При прокаливании вся кристаллизационная вода испаряется, оставляя безводную соль. Уравнение реакции:
$FeSO_4 \cdot nH_2O \xrightarrow{t^\circ C} FeSO_4 + nH_2O\uparrow$
1. Найдем массу воды, которая содержалась в кристаллогидрате. Она равна разности масс кристаллогидрата и безводной соли:
$m(H_2O) = m(FeSO_4 \cdot nH_2O) - m(FeSO_4) = 69,5 \text{ г} - 38 \text{ г} = 31,5 \text{ г}$
2. Чтобы определить значение $n$ в формуле, необходимо найти соотношение количеств вещества (в молях) безводной соли и воды.
Вычислим молярные массы сульфата железа(II) и воды, используя относительные атомные массы элементов из периодической таблицы: $Ar(Fe) = 56$, $Ar(S) = 32$, $Ar(O) = 16$, $Ar(H) = 1$.
Молярная масса сульфата железа(II) ($FeSO_4$):
$M(FeSO_4) = 56 + 32 + 4 \cdot 16 = 152$ г/моль
Молярная масса воды ($H_2O$):
$M(H_2O) = 2 \cdot 1 + 16 = 18$ г/моль
3. Рассчитаем количество вещества ($\nu$) для безводной соли и воды по формуле $\nu = \frac{m}{M}$:
Количество вещества сульфата железа(II):
$\nu(FeSO_4) = \frac{m(FeSO_4)}{M(FeSO_4)} = \frac{38 \text{ г}}{152 \text{ г/моль}} = 0,25$ моль
Количество вещества воды:
$\nu(H_2O) = \frac{m(H_2O)}{M(H_2O)} = \frac{31,5 \text{ г}}{18 \text{ г/моль}} = 1,75$ моль
4. Соотношение количеств вещества соли и воды в кристаллогидрате равно соотношению их стехиометрических коэффициентов в формуле:
$\nu(FeSO_4) : \nu(H_2O) = 1 : n$
Отсюда найдем $n$:
$n = \frac{\nu(H_2O)}{\nu(FeSO_4)} = \frac{1,75 \text{ моль}}{0,25 \text{ моль}} = 7$
Таким образом, на одну молекулу сульфата железа(II) приходится 7 молекул воды.
Ответ: формула кристаллогидрата - $FeSO_4 \cdot 7H_2O$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 57 расположенного на странице 109 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №57 (с. 109), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















