Дополнительное задание, страница 83 - гдз по химии 9 класс тетрадь для лабораторных опытов и практических работ Габриелян, Аксенова

Авторы: Габриелян О. С., Аксенова И. В., Остроумов И. Г.
Тип: Тетрадь для лабораторных опытов и практических работ
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, синий
ISBN: 978-5-09-072533-0
Популярные ГДЗ в 9 классе
Химические свойства разбавленной азотной кислоты. Лабораторный опыт 37 - страница 83.
Дополнительное задание (с. 83)
Условие. Дополнительное задание (с. 83)
скриншот условия
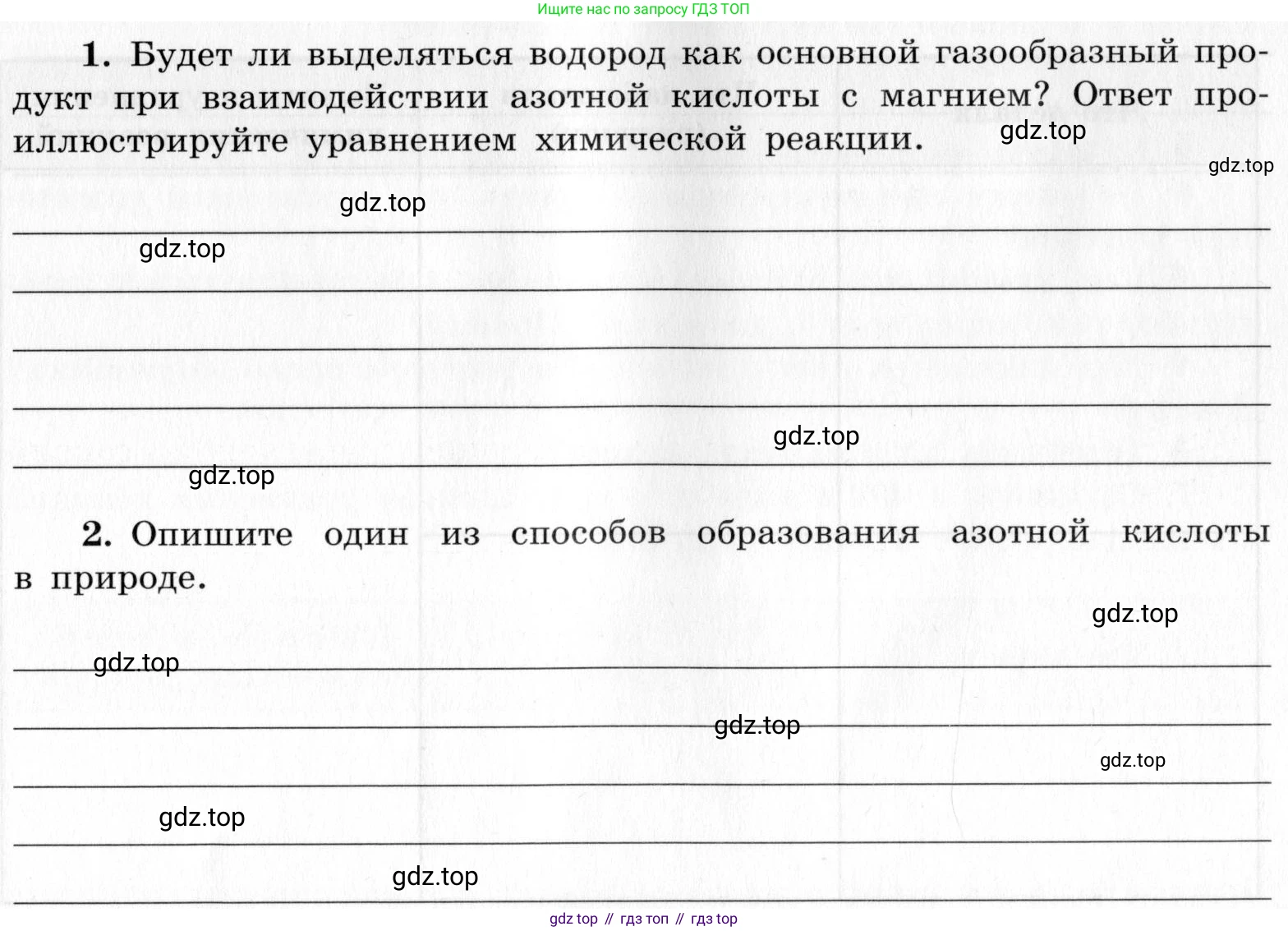
1. Будет ли выделяться водород как основной газообразный продукт при взаимодействии азотной кислоты с магнием? Ответ проиллюстрируйте уравнением химической реакции.
2. Опишите один из способов образования азотной кислоты в природе.
Решение. Дополнительное задание (с. 83)

Решение 2. Дополнительное задание (с. 83)
1. Будет ли выделяться водород как основной газообразный продукт при взаимодействии азотной кислоты с магнием? Ответ проиллюстрируйте уравнением химической реакции.
Нет, водород не будет выделяться как основной газообразный продукт при взаимодействии азотной кислоты с магнием. Азотная кислота является сильным окислителем, и при ее реакции с активными металлами, такими как магний, происходит восстановление азота, а не водорода. В зависимости от концентрации кислоты и активности металла, продуктами восстановления азота могут быть различные оксиды азота (например, оксид азота(I) $\text{N}_2\text{O}$, оксид азота(II) $\text{NO}$, диоксид азота $\text{NO}_2$) или даже аммонийные соли (например, нитрат аммония $\text{NH}_4\text{NO}_3$), если кислота очень разбавленная. Водород выделяется только при взаимодействии металлов с кислотами-неокислителями или в случае крайне разбавленной азотной кислоты с некоторыми очень активными металлами, но даже тогда, это редко является основным продуктом.
Например, при взаимодействии магния с разбавленной азотной кислотой образуется оксид азота(I) ($\text{N}_2\text{O}$):
$4\text{Mg} + 10\text{HNO}_3 \rightarrow 4\text{Mg(NO}_3\text{)}_2 + \text{N}_2\text{O} \uparrow + 5\text{H}_2\text{O}$
Или, в случае очень разбавленной кислоты, может образоваться нитрат аммония (без газообразных продуктов):
$4\text{Mg} + 10\text{HNO}_3 \rightarrow 4\text{Mg(NO}_3\text{)}_2 + \text{NH}_4\text{NO}_3 + 3\text{H}_2\text{O}$
Ответ: Нет, водород не будет основным газообразным продуктом.
2. Опишите один из способов образования азотной кислоты в природе.
Один из основных способов образования азотной кислоты в природе связан с электрическими разрядами в атмосфере, то есть молниями. Этот процесс происходит в несколько стадий:
Во время грозы, мощные электрические разряды (молнии) обеспечивают высокую энергию, необходимую для разрыва ковалентных связей в молекулах атмосферного азота ($\text{N}_2$) и кислорода ($\text{O}_2$). Азот и кислород, присутствующие в воздухе, реагируют друг с другом, образуя оксид азота(II):
$\text{N}_2 (\text{г}) + \text{O}_2 (\text{г}) \xrightarrow{\text{молния}} 2\text{NO} (\text{г})$
Образовавшийся оксид азота(II) быстро реагирует с избытком кислорода в воздухе, образуя диоксид азота:
$2\text{NO} (\text{г}) + \text{O}_2 (\text{г}) \rightarrow 2\text{NO}_2 (\text{г})$
Затем диоксид азота вступает в реакцию с водой (например, в каплях дождя) и дополнительным кислородом, что приводит к образованию азотной кислоты:
$4\text{NO}_2 (\text{г}) + \text{O}_2 (\text{г}) + 2\text{H}_2\text{O} (\text{ж}) \rightarrow 4\text{HNO}_3 (\text{водн.})$
Таким образом, азотная кислота, образовавшаяся в результате этих реакций, попадает на поверхность Земли с дождем, способствуя круговороту азота в природе и обогащая почву нитратами.
Ответ: Азотная кислота образуется в природе в результате атмосферных электрических разрядов (молний), которые вызывают реакцию азота и кислорода с последующим взаимодействием продуктов с водой.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения Дополнительное задание расположенного на странице 83 к Тетрадь для лабораторных опытов и практических работ 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Дополнительное задание (с. 83), авторов: Габриелян (Олег Саргисович), Аксенова (Инна Васильевна), Остроумов (Игорь Геннадьевич), ФГОС (старый) учебного пособия издательства Просвещение.















