Номер 5, страница 96 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 5. Азот и фосфор. Параграф 27. Азотная кислота. Подумай, ответь, выполни... - номер 5, страница 96.
№5 (с. 96)
Условие. №5 (с. 96)
скриншот условия

5. Напишите уравнения реакций, протекающих между серебром и разбавленной, а также концентрированной азотной кислотой. Покажите переход электронов и подчеркните окислитель одной чертой, а восстановитель двумя.
Решение. №5 (с. 96)

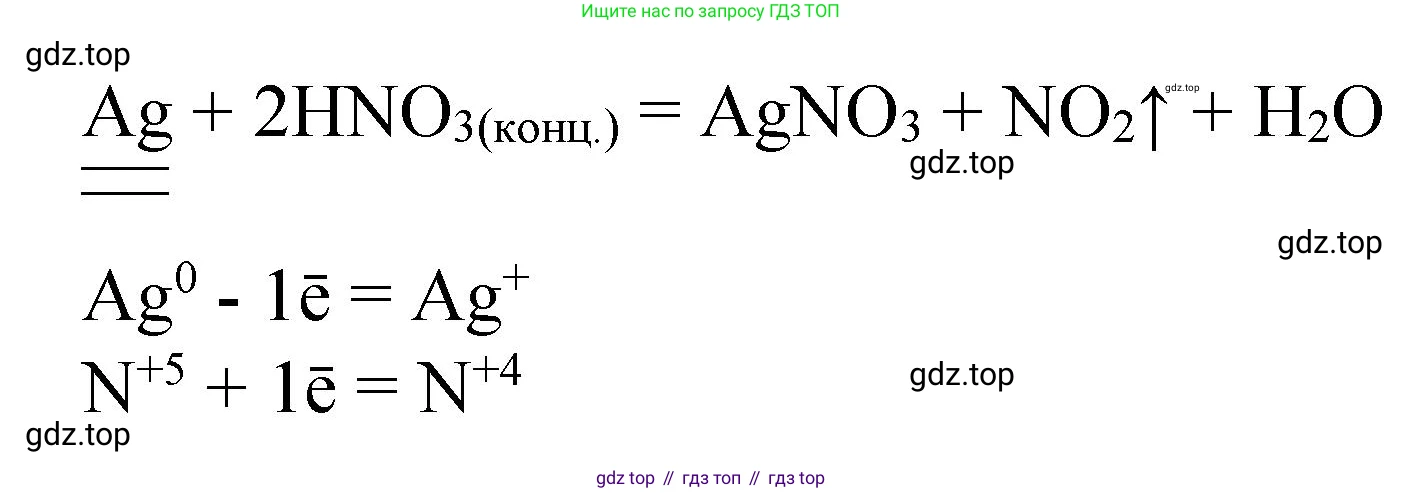
Решение 2. №5 (с. 96)
Решение
Взаимодействие серебра с разбавленной азотной кислотой
Серебро, как металл, стоящий в ряду напряжений после водорода, не вытесняет его из кислот. Однако азотная кислота является сильным окислителем и реагирует с серебром. При взаимодействии серебра с разбавленной азотной кислотой образуются нитрат серебра(I), оксид азота(II) и вода.
В этой реакции серебро является восстановителем, а азотная кислота (за счет азота в степени окисления +5) — окислителем.
Составим схему электронного баланса, чтобы расставить коэффициенты в уравнении реакции:
$Ag^0 - 1e^- \rightarrow Ag^{+1}$ | 3 (процесс окисления, Ag - восстановитель)
$N^{+5} + 3e^- \rightarrow N^{+2}$ | 1 (процесс восстановления, $HNO_3$ - окислитель)
Суммарное уравнение реакции с расставленными коэффициентами и указанием окислителя и восстановителя:
$3 Ag + 4 HNO_3(разб.) \rightarrow 3AgNO_3 + NO\uparrow + 2H_2O$
Здесь Ag (серебро) — восстановитель (подчеркнут двумя чертами), а $HNO_3$ (азотная кислота) — окислитель (подчеркнута одной чертой).
Ответ: $3 Ag + 4 HNO_3(разб.) \rightarrow 3AgNO_3 + NO\uparrow + 2H_2O$. Переход электронов: $Ag^0 - 1e^- \rightarrow Ag^{+1}$; $N^{+5} + 3e^- \rightarrow N^{+2}$.
Взаимодействие серебра с концентрированной азотной кислотой
При реакции серебра с концентрированной азотной кислотой продуктами являются нитрат серебра(I), диоксид азота(IV) и вода. Продукт восстановления азота зависит от концентрации кислоты: в концентрированной кислоте азот восстанавливается до степени окисления +4.
В этой реакции серебро также выступает в роли восстановителя, а азотная кислота — в роли окислителя.
Схема электронного баланса для этой реакции:
$Ag^0 - 1e^- \rightarrow Ag^{+1}$ | 1 (процесс окисления, Ag - восстановитель)
$N^{+5} + 1e^- \rightarrow N^{+4}$ | 1 (процесс восстановления, $HNO_3$ - окислитель)
Коэффициенты равны 1, так как число отданных и принятых электронов совпадает. Уравняем остальные элементы и получим итоговое уравнение:
$ Ag + 2 HNO_3(конц.) \rightarrow AgNO_3 + NO_2\uparrow + H_2O$
Здесь Ag (серебро) — восстановитель (подчеркнут двумя чертами), а $HNO_3$ (азотная кислота) — окислитель (подчеркнута одной чертой).
Ответ: $ Ag + 2 HNO_3(конц.) \rightarrow AgNO_3 + NO_2\uparrow + H_2O$. Переход электронов: $Ag^0 - 1e^- \rightarrow Ag^{+1}$; $N^{+5} + 1e^- \rightarrow N^{+4}$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 5 расположенного на странице 96 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 96), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















