Номер 82, страница 20 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 1. Основные понятия органической химии. 1.3. Электронное строение атома углерода. Электронные эффекты в органической химии. Уровень 1 - номер 82, страница 20.
№82 (с. 20)
Условие. №82 (с. 20)
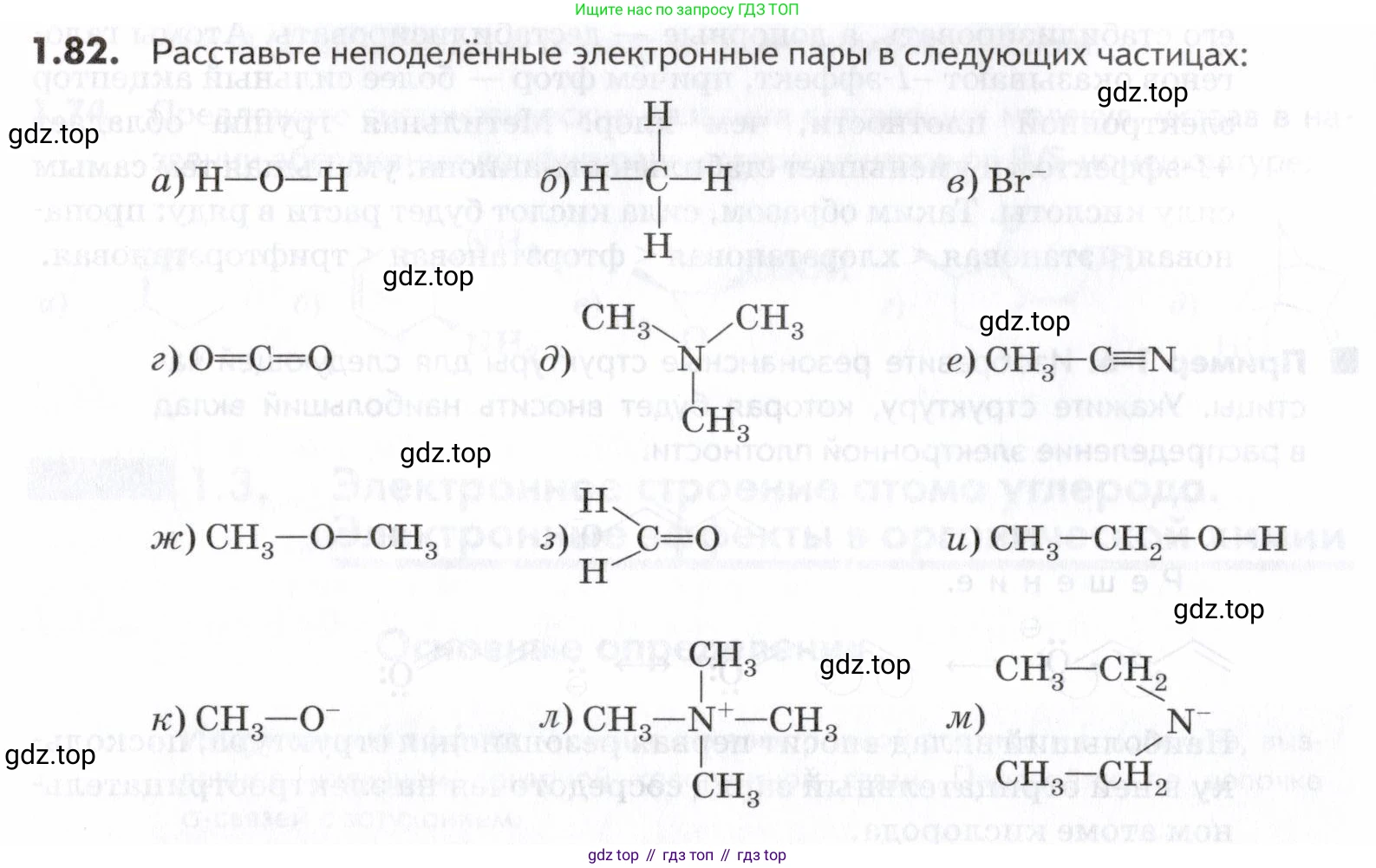
1.82. Расставьте неподелённые электронные пары в следующих частицах:
Решение. №82 (с. 20)
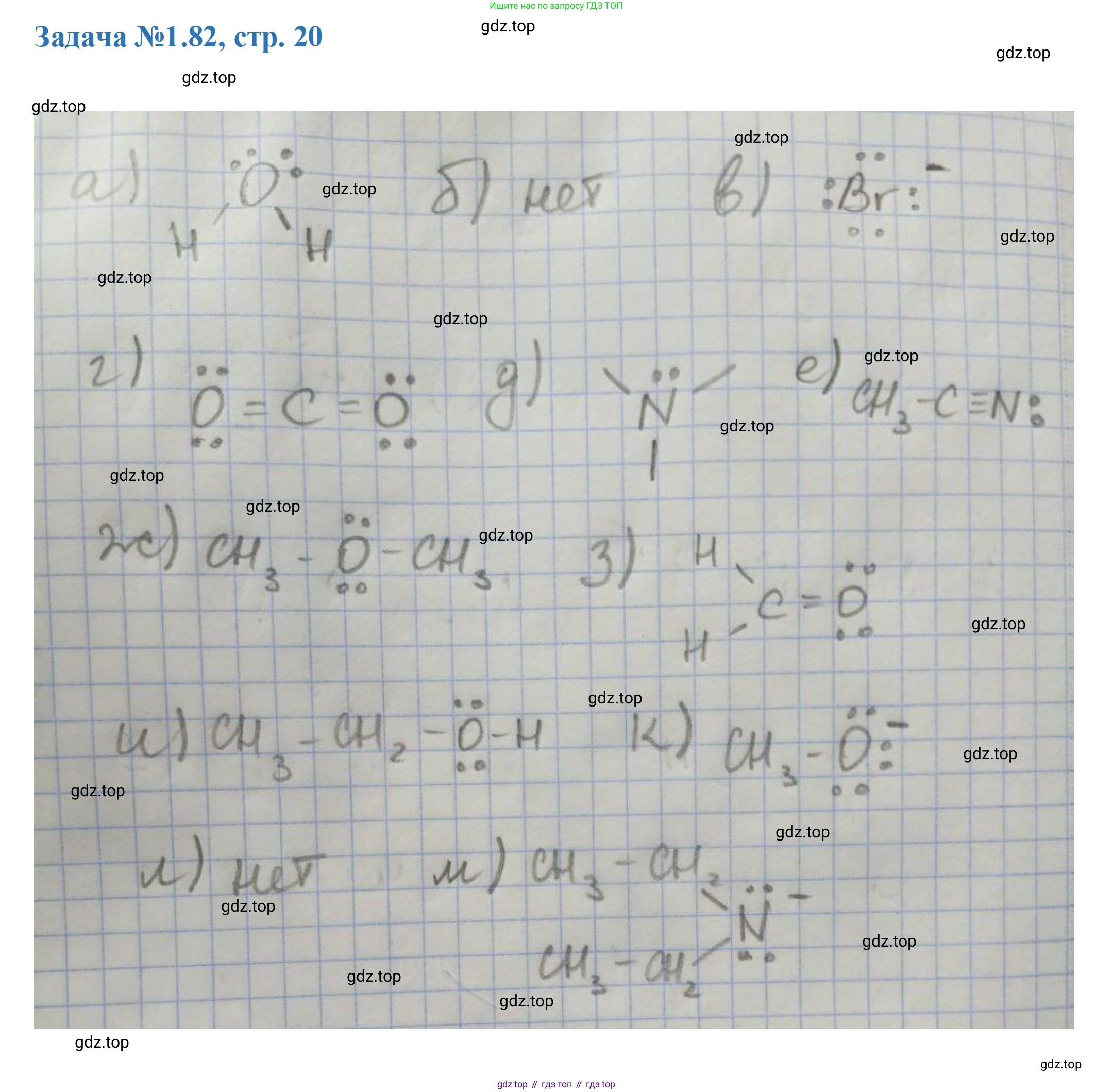
Решение 3. №82 (с. 20)
а) H-O-H
В молекуле воды ($H_2O$) атом кислорода связан с двумя атомами водорода одинарными ковалентными связями. У атома кислорода 6 валентных электронов. Два из них участвуют в образовании связей. Оставшиеся 4 электрона образуют две неподелённые электронные пары, которые располагаются на атоме кислорода, дополняя его электронную оболочку до октета.
Ответ: $H-\ddot{O}-H$
б) H-C-H c двумя H, присоединенными к CВ молекуле метана ($CH_4$) атом углерода связан с четырьмя атомами водорода. У атома углерода 4 валентных электрона, и все они участвуют в образовании четырёх ковалентных связей. У атомов водорода по одному валентному электрону, и они также полностью задействованы в связях. Таким образом, в молекуле метана неподелённые электронные пары отсутствуют.
Ответ: Неподелённые электронные пары отсутствуют. Структура: $CH_4$.
в) Br⁻Атом брома (Br) находится в 17-й группе и имеет 7 валентных электронов. Бромид-ион ($Br^−$) образуется, когда атом брома принимает один дополнительный электрон. В результате ион имеет 8 электронов на внешней оболочке, которые образуют четыре неподелённые электронные пары.
Ответ: $[:\ddot{Br}:]^-$
г) O=C=OВ молекуле диоксида углерода ($CO_2$) атом углерода образует две двойные связи с двумя атомами кислорода. Каждый атом кислорода имеет 6 валентных электронов. Четыре электрона (два для образования двойной связи) от каждого атома кислорода участвуют в связи с углеродом, а оставшиеся 4 электрона образуют две неподелённые электронные пары на каждом атоме кислорода.
Ответ: $:\ddot{O}=C=\ddot{O}:$
д) N(CH₃)₃В молекуле триметиламина ($N(CH_3)_3$) атом азота связан с тремя углеродными атомами метильных групп. Атом азота имеет 5 валентных электронов. Три из них используются для образования трёх одинарных связей. Оставшиеся 2 электрона образуют одну неподелённую электронную пару на атоме азота.
Ответ: $\begin{array}{c} CH_3-\ddot{N}-CH_3 \\ | \\ CH_3 \end{array}$
е) CH₃-C≡NВ молекуле ацетонитрила ($CH_3CN$) атом азота связан с атомом углерода тройной связью. Атом азота имеет 5 валентных электронов. Три из них участвуют в образовании тройной связи. Оставшиеся 2 электрона образуют одну неподелённую электронную пару на атоме азота.
Ответ: $CH_3-C\equiv N:$
ж) CH₃-O-CH₃В молекуле диметилового эфира ($CH_3OCH_3$) атом кислорода связан с двумя углеродными атомами метильных групп. Атом кислорода имеет 6 валентных электронов. Два из них используются для образования двух одинарных связей. Оставшиеся 4 электрона образуют две неподелённые электронные пары на атоме кислорода.
Ответ: $CH_3-\ddot{O}-CH_3$
з) H₂C=OВ молекуле формальдегида ($H_2CO$) атом кислорода связан с атомом углерода двойной связью. Атом кислорода имеет 6 валентных электронов. Два из них участвуют в образовании двойной связи. Оставшиеся 4 электрона образуют две неподелённые электронные пары на атоме кислорода. Атом углерода использует все свои 4 валентных электрона на образование связей и не имеет неподеленных пар.
Ответ: $\begin{array}{c} H \\ | \\ C=\ddot{O} \\ | \\ H \end{array}$
и) CH₃-CH₂-O-HВ молекуле этанола ($CH_3CH_2OH$) атом кислорода связан с атомом углерода этильной группы и с атомом водорода. Атом кислорода имеет 6 валентных электронов. Два из них используются для образования двух одинарных связей. Оставшиеся 4 электрона образуют две неподелённые электронные пары на атоме кислорода.
Ответ: $CH_3-CH_2-\ddot{O}-H$
к) CH₃-O⁻В метоксид-анионе ($CH_3O^−$) атом кислорода связан с углеродным атомом метильной группы и несет отрицательный заряд. Атом кислорода имеет 6 валентных электронов, плюс один дополнительный электрон из-за отрицательного заряда, итого 7. Один электрон используется для образования связи с углеродом. Оставшиеся 6 электронов образуют три неподелённые электронные пары на атоме кислорода.
Ответ: $[CH_3-\ddot{O}:]^-$
л) CH₃-N⁺-(CH₃)₂-CH₃В ионе тетраметиламмония ($[N(CH_3)_4]^+$) атом азота связан с четырьмя углеродными атомами метильных групп и несет положительный заряд. Атом азота имеет 5 валентных электронов. Из-за положительного заряда он теряет один электрон, и у него остается 4 валентных электрона. Все четыре электрона участвуют в образовании четырёх одинарных связей. Таким образом, на атоме азота неподелённые электронные пары отсутствуют.
Ответ: Неподелённые электронные пары отсутствуют. Структура: $\left[ \begin{array}{c} \quad CH_3 \\ \quad | \\ CH_3-N^+-CH_3 \\ | \\ CH_3 \end{array} \right]^+$
м) (CH₃-CH₂)₂N⁻В диэтиламид-анионе ([(CH₃CH₂)₂N]⁻) атом азота связан с двумя углеродными атомами этильных групп и несет отрицательный заряд. Атом азота имеет 5 валентных электронов, плюс один дополнительный электрон из-за отрицательного заряда, итого 6. Два электрона используются для образования двух одинарных связей с атомами углерода. Оставшиеся 4 электрона образуют две неподелённые электронные пары на атоме азота.
Ответ: $[(CH_3CH_2)_2\ddot{N}]^-$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 82 расположенного на странице 20 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №82 (с. 20), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















