Номер 89, страница 22 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 1. Основные понятия органической химии. 1.3. Электронное строение атома углерода. Электронные эффекты в органической химии. Уровень 2 - номер 89, страница 22.
№89 (с. 22)
Условие. №89 (с. 22)

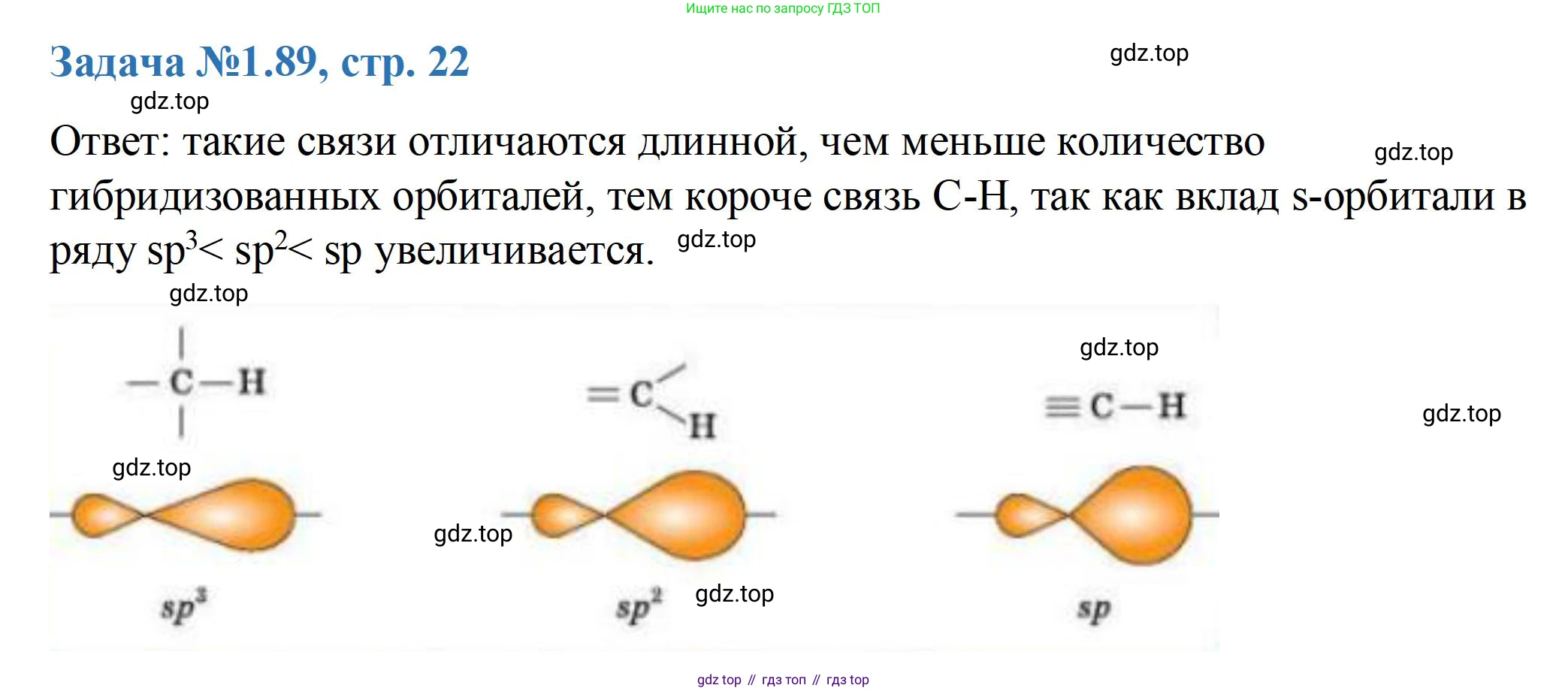
1.89. Чем отличаются друг от друга С–Н связи, образованные атомами углерода в различных гибридных состояниях?
Решение. №89 (с. 22)
Решение 3. №89 (с. 22)
Решение
Связи C—H, образованные атомами углерода в различных гибридных состояниях ($sp^3$, $sp^2$ и $sp$), отличаются друг от друга по ряду ключевых характеристик: длине, прочности (энергии), полярности и кислотности. Причиной этих различий является разный вклад s-орбитали, или так называемый s-характер, в гибридную орбиталь углерода, которая образует связь с водородом.
В зависимости от типа гибридизации s-характер изменяется. Для $sp^3$-гибридизации (например, в алканах, как метан $CH_4$) он составляет 25%, так как гибридная орбиталь образована из одной s- и трех p-орбиталей. Для $sp^2$-гибридизации (например, в алкенах, как этен $C_2H_4$) s-характер равен примерно 33.3% (одна s- и две p-орбитали). Для $sp$-гибридизации (например, в алкинах, как ацетилен $C_2H_2$) s-характер достигает максимального значения в 50% (одна s- и одна p-орбиталь).
Поскольку s-орбитали имеют сферическую форму и расположены ближе к ядру атома, чем вытянутые p-орбитали, увеличение s-характера гибридной орбитали приводит к следующим изменениям свойств связи C—H:
Во-первых, изменяется длина связи. С ростом s-характера гибридная орбиталь углерода становится короче и компактнее. Это приводит к более эффективному перекрыванию с 1s-орбиталью водорода и, как следствие, к укорочению связи. Длина связи C—H уменьшается в ряду: $C_{sp^3}—H$ > $C_{sp^2}—H$ > $C_{sp}—H$.
Во-вторых, изменяется прочность (энергия) связи. Укорочение связи ведет к ее упрочнению. Энергия, необходимая для разрыва связи, возрастает с увеличением s-характера. Таким образом, прочность связи C—H увеличивается в ряду: $C_{sp}—H$ > $C_{sp^2}—H$ > $C_{sp^3}—H$.
В-третьих, изменяется электроотрицательность углерода и полярность связи. Электроны на орбитали с большим s-характером сильнее притягиваются к ядру, что повышает эффективную электроотрицательность атома углерода. В результате полярность связи C—H возрастает, а электронная плотность смещается от водорода к углероду в большей степени. Электроотрицательность углерода растет в ряду: $C_{sp}$ > $C_{sp^2}$ > $C_{sp^3}$.
В-четвертых, изменяется кислотность водорода. Увеличение полярности связи и, что более важно, повышение стабильности образующегося карбаниона (сопряженного основания) после отщепления протона $H^+$ делают водород более "кислым". Неподеленная электронная пара в карбанионе занимает гибридную орбиталь. Чем выше ее s-характер, тем ниже энергия аниона и тем он стабильнее. Поэтому C—H кислотность значительно возрастает в ряду: $C_{sp}—H$ >> $C_{sp^2}—H$ > $C_{sp^3}—H$.
Ответ:
Связи C—H, образованные атомами углерода в разных гибридных состояниях ($sp^3$, $sp^2$, $sp$), отличаются по своим ключевым характеристикам: длине, прочности (энергии), полярности и кислотности. Эти отличия определяются долей s-орбитали (s-характером) в гибридной орбитали углерода. При переходе от $sp^3$ к $sp^2$ и далее к $sp$-гибридизации s-характер возрастает (25% → 33,3% → 50%), что приводит к следующим закономерностям: длина связи C—H уменьшается, в то время как ее прочность, полярность и кислотность связанного атома водорода увеличиваются.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 89 расположенного на странице 22 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №89 (с. 22), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















