Номер 83, страница 21 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 1. Основные понятия органической химии. 1.3. Электронное строение атома углерода. Электронные эффекты в органической химии. Уровень 1 - номер 83, страница 21.
№83 (с. 21)
Условие. №83 (с. 21)
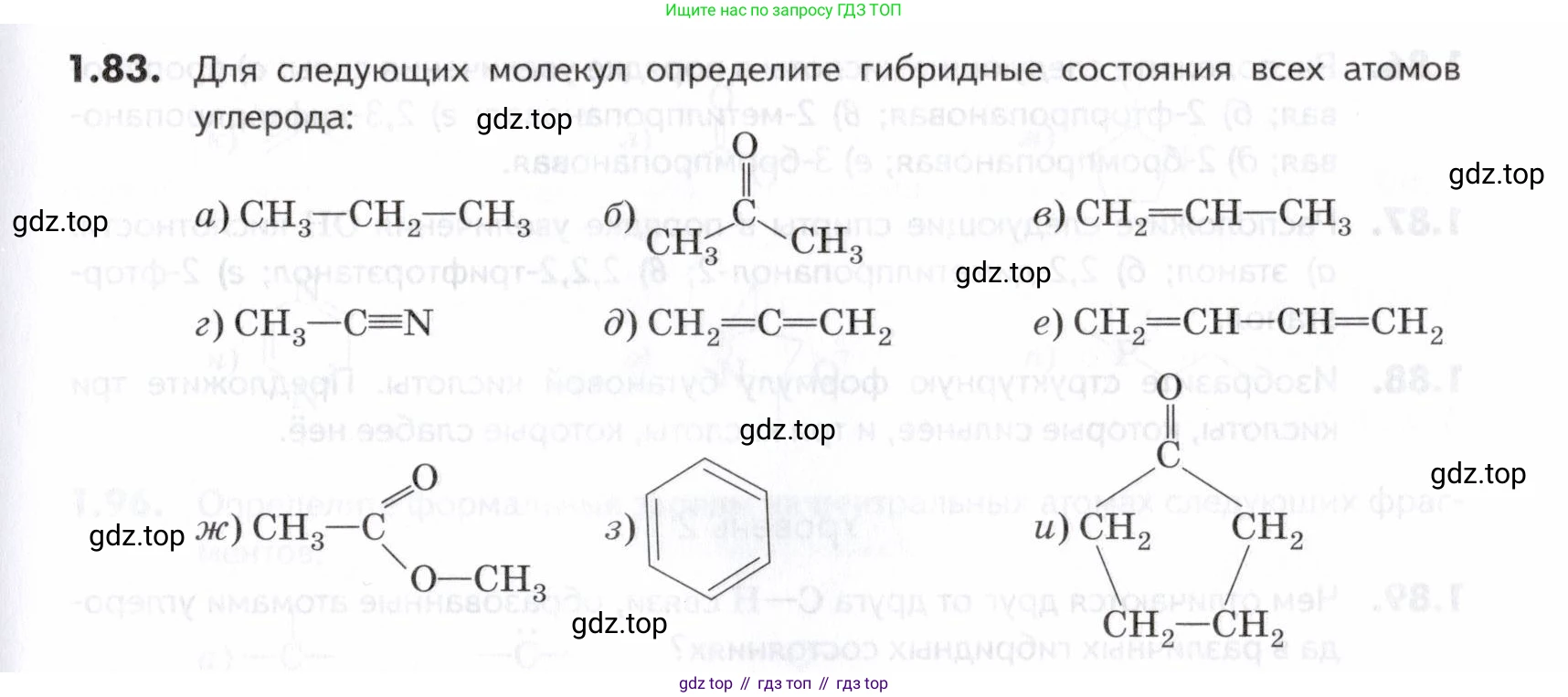
1.83. Для следующих молекул определите гибридные состояния всех атомов:
Решение. №83 (с. 21)

Решение 3. №83 (с. 21)
Гибридное состояние атома определяется числом его σ-связей и неподеленных электронных пар. Если сумма σ-связей и неподеленных пар равна 4, гибридизация – $sp^3$; если 3 – $sp^2$; если 2 – $sp$.
а) CH₃—CH₂—CH₃ (пропан)В молекуле пропана все атомы углерода связаны только одинарными (сигма, σ) связями.
- Концевые атомы углерода (в группах $CH_3$) образуют 4 σ-связи: три с атомами водорода и одну с центральным атомом углерода. Число σ-связей и неподеленных пар равно 4, следовательно, их гибридизация – $sp^3$.
- Центральный атом углерода (в группе $CH_2$) образует 4 σ-связи: две с атомами водорода и две с концевыми атомами углерода. Число σ-связей и неподеленных пар равно 4, следовательно, его гибридизация также $sp^3$.
Ответ: все атомы углерода находятся в состоянии $sp^3$-гибридизации.
б) CH₃—C(=O)—CH₃ (ацетон)- Атомы углерода в метильных группах ($CH_3$) связаны с центральным атомом углерода одинарной связью. Каждый из них образует 4 σ-связи (3 с H, 1 с C), поэтому их гибридизация – $sp^3$.
- Атом углерода карбонильной группы (C=O) связан с двумя атомами углерода одинарными связями (2 σ-связи) и с атомом кислорода двойной связью (1 σ-связь и 1 π-связь). Всего 3 σ-связи, неподеленных пар нет. Число σ-связей и неподеленных пар равно 3, следовательно, его гибридизация – $sp^2$.
- Атом кислорода карбонильной группы имеет двойную связь с углеродом (1 σ-связь) и две неподеленные электронные пары. Число σ-связей и неподеленных пар равно 1 + 2 = 3. Гибридизация атома кислорода – $sp^2$.
Ответ: атомы углерода в группах $CH_3$ – $sp^3$; атом углерода карбонильной группы – $sp^2$; атом кислорода – $sp^2$.
в) CH₂=CH—CH₃ (пропен)Пронумеруем атомы углерода слева направо: $C^1H_2=C^2H—C^3H_3$.
- Атом $C^1$ образует двойную связь с $C^2$ (1 σ, 1 π) и две одинарные связи с атомами водорода (2 σ). Всего 3 σ-связи, гибридизация – $sp^2$.
- Атом $C^2$ образует двойную связь с $C^1$ (1 σ), одинарную с $C^3$ (1 σ) и одинарную с водородом (1 σ). Всего 3 σ-связи, гибридизация – $sp^2$.
- Атом $C^3$ в метильной группе образует 4 одинарные σ-связи (3 с H, 1 с C). Гибридизация – $sp^3$.
Ответ: $C^1$ и $C^2$ – $sp^2$; $C^3$ – $sp^3$.
г) CH₃—C≡N (ацетонитрил)- Атом углерода в метильной группе ($CH_3$) образует 4 σ-связи (3 с H, 1 с C). Гибридизация – $sp^3$.
- Атом углерода в нитрильной группе (C≡N) связан с метильной группой одинарной связью (1 σ) и с атомом азота тройной связью (1 σ, 2 π). Всего 2 σ-связи. Гибридизация – $sp$.
- Атом азота связан с углеродом тройной связью (1 σ) и имеет одну неподеленную электронную пару. Число σ-связей и неподеленных пар равно 1 + 1 = 2. Гибридизация – $sp$.
Ответ: атом углерода в $CH_3$ – $sp^3$; атом углерода в группе C≡N – $sp$; атом азота – $sp$.
д) CH₂=C=CH₂ (аллен)Пронумеруем атомы углерода слева направо: $C^1H_2=C^2=C^3H_2$.
- Концевые атомы углерода $C^1$ и $C^3$ образуют по одной двойной связи с центральным атомом углерода (1 σ) и по две одинарные связи с атомами водорода (2 σ). Всего у каждого по 3 σ-связи, гибридизация – $sp^2$.
- Центральный атом углерода $C^2$ образует две двойные связи с соседними атомами углерода. Каждая двойная связь содержит одну σ-связь. Всего 2 σ-связи, гибридизация – $sp$.
Ответ: $C^1$ и $C^3$ – $sp^2$; $C^2$ – $sp$.
е) CH₂=CH—CH=CH₂ (бутадиен-1,3)В этой молекуле все атомы углерода участвуют в образовании двойных связей.
- Концевые атомы углерода (в группах $CH_2$) образуют по одной двойной связи (1 σ) и по две одинарные связи с атомами водорода (2 σ). Всего 3 σ-связи, гибридизация – $sp^2$.
- Центральные атомы углерода (в группах $CH$) образуют по одной двойной связи (1 σ), одной одинарной связи с другим углеродом (1 σ) и одной одинарной связи с водородом (1 σ). Всего 3 σ-связи, гибридизация – $sp^2$.
Ответ: все четыре атома углерода находятся в состоянии $sp^2$-гибридизации.
ж) CH₃—C(=O)—O—CH₃ (метилацетат)- Атом углерода в метильной группе, связанной с карбонильным углеродом ($CH_3$—C=O), образует 4 σ-связи. Гибридизация – $sp^3$.
- Карбонильный атом углерода (C=O) образует 3 σ-связи (с C, с O и с другим O). Гибридизация – $sp^2$.
- Атом кислорода карбонильной группы (=O) имеет одну σ-связь и две неподеленные пары. Сумма равна 3. Гибридизация – $sp^2$.
- Атом кислорода в эфирной группе (—O—) образует 2 σ-связи (с двумя C) и имеет две неподеленные пары. Сумма равна 4. Гибридизация – $sp^3$.
- Атом углерода в метильной группе, связанной с эфирным кислородом (O—$CH_3$), образует 4 σ-связи. Гибридизация – $sp^3$.
Ответ: углерод в $CH_3$—C=O – $sp^3$; углерод в C=O – $sp^2$; кислород в C=O – $sp^2$; кислород в —O— – $sp^3$; углерод в O—$CH_3$ – $sp^3$.
з) Бензол (C₆H₆)В молекуле бензола все шесть атомов углерода образуют ароматическую систему. Каждый атом углерода связан с двумя другими атомами углерода и одним атомом водорода. Это составляет 3 σ-связи для каждого атома углерода. Четвертый валентный электрон каждого атома углерода образует единую сопряженную π-систему. Поскольку каждый атом углерода образует 3 σ-связи, все они находятся в состоянии $sp^2$-гибридизации.
Ответ: все шесть атомов углерода находятся в состоянии $sp^2$-гибридизации.
и) ЦиклопентанонЭто пятичленный цикл с одной карбонильной группой.
- Атом углерода карбонильной группы (C=O) связан с двумя другими атомами углерода в цикле (2 σ-связи) и с атомом кислорода (1 σ-связь). Всего 3 σ-связи, гибридизация – $sp^2$.
- Атом кислорода карбонильной группы (=O) имеет одну σ-связь и две неподеленные пары. Сумма равна 3. Гибридизация – $sp^2$.
- Остальные четыре атома углерода в цикле ($CH_2$ группы) являются насыщенными. Каждый из них образует 4 σ-связи: две с соседними атомами углерода в цикле и две с атомами водорода. Их гибридизация – $sp^3$.
Ответ: атом углерода карбонильной группы – $sp^2$; атом кислорода – $sp^2$; остальные четыре атома углерода в цикле – $sp^3$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 83 расположенного на странице 21 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №83 (с. 21), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















