Номер 96, страница 23 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 1. Основные понятия органической химии. 1.3. Электронное строение атома углерода. Электронные эффекты в органической химии. Уровень 2 - номер 96, страница 23.
№96 (с. 23)
Условие. №96 (с. 23)
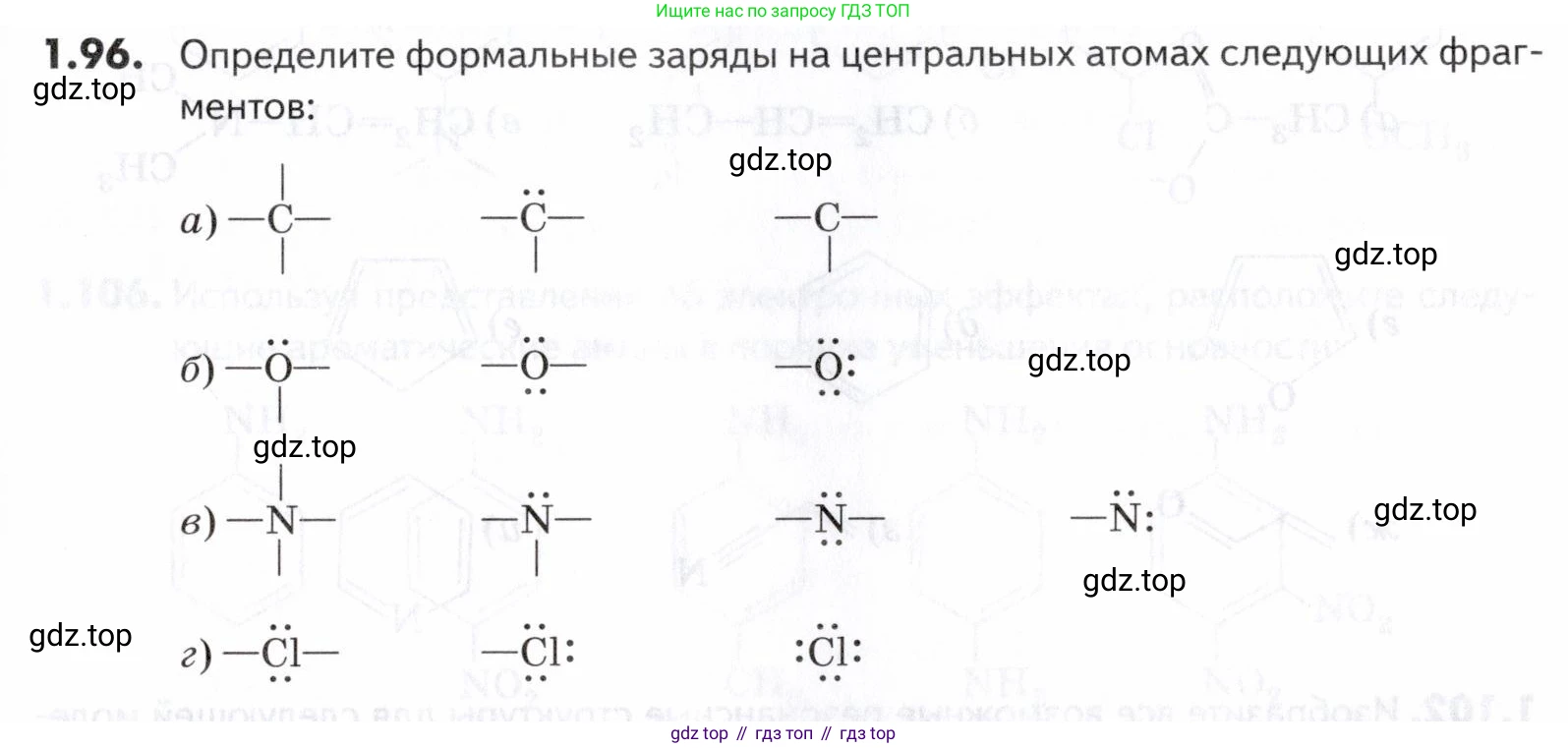
1.96. Определите формальные заряды на центральных атомах следующих фрагментов:
Решение. №96 (с. 23)
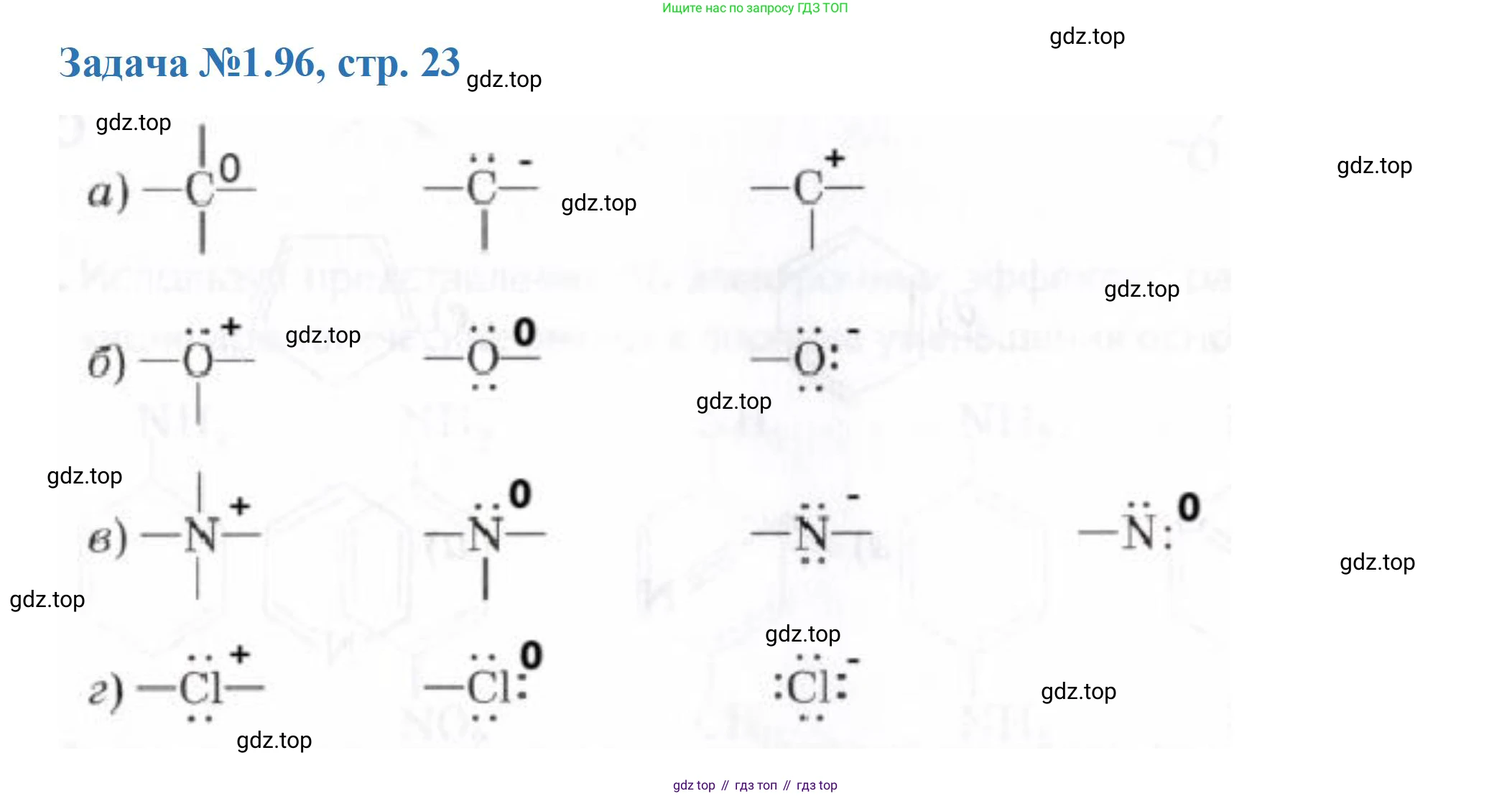
Решение 3. №96 (с. 23)
Формальный заряд (ФЗ) на атоме в молекуле или ионе определяется по формуле:
$ФЗ = (\text{число валентных электронов свободного атома}) - (\text{число неподеленных электронов}) - \frac{1}{2} (\text{число связывающих электронов})$
В краткой форме: $ФЗ = V - N - B/2$, где $V$ – номер группы элемента (число валентных электронов), $N$ – число электронов в неподеленных парах (каждая пара – 2 электрона), $B$ – число электронов в ковалентных связях (каждая связь – 2 электрона).
Число валентных электронов для рассматриваемых атомов:
- Углерод (C): $V = 4$
- Кислород (O): $V = 6$
- Азот (N): $V = 5$
- Хлор (Cl): $V = 7$
а) Расчет формальных зарядов для атомов углерода:
- Атом углерода образует 4 одинарные связи.
Число неподеленных электронов $N = 0$.
Число связывающих электронов $B = 4 \times 2 = 8$.
Формальный заряд: $ФЗ = 4 - 0 - 8/2 = 0$. - Атом углерода образует 3 одинарные связи и имеет одну неподеленную электронную пару.
Число неподеленных электронов $N = 2$.
Число связывающих электронов $B = 3 \times 2 = 6$.
Формальный заряд: $ФЗ = 4 - 2 - 6/2 = -1$. - Атом углерода образует 3 одинарные связи и не имеет неподеленных электронных пар.
Число неподеленных электронов $N = 0$.
Число связывающих электронов $B = 3 \times 2 = 6$.
Формальный заряд: $ФЗ = 4 - 0 - 6/2 = +1$.
Ответ: 0, -1, +1.
б) Расчет формальных зарядов для атомов кислорода:
- Атом кислорода образует 3 одинарные связи и имеет одну неподеленную электронную пару.
Число неподеленных электронов $N = 2$.
Число связывающих электронов $B = 3 \times 2 = 6$.
Формальный заряд: $ФЗ = 6 - 2 - 6/2 = +1$. - Атом кислорода образует 2 одинарные связи и имеет две неподеленные электронные пары.
Число неподеленных электронов $N = 4$.
Число связывающих электронов $B = 2 \times 2 = 4$.
Формальный заряд: $ФЗ = 6 - 4 - 4/2 = 0$. - Атом кислорода образует 1 одинарную связь и имеет три неподеленные электронные пары.
Число неподеленных электронов $N = 6$.
Число связывающих электронов $B = 1 \times 2 = 2$.
Формальный заряд: $ФЗ = 6 - 6 - 2/2 = -1$.
Ответ: +1, 0, -1.
в) Расчет формальных зарядов для атомов азота:
- Атом азота образует 4 одинарные связи.
Число неподеленных электронов $N = 0$.
Число связывающих электронов $B = 4 \times 2 = 8$.
Формальный заряд: $ФЗ = 5 - 0 - 8/2 = +1$. - Атом азота образует 3 одинарные связи и имеет одну неподеленную электронную пару.
Число неподеленных электронов $N = 2$.
Число связывающих электронов $B = 3 \times 2 = 6$.
Формальный заряд: $ФЗ = 5 - 2 - 6/2 = 0$. - Атом азота образует 2 одинарные связи и имеет одну неподеленную электронную пару.
Число неподеленных электронов $N = 2$.
Число связывающих электронов $B = 2 \times 2 = 4$.
Формальный заряд: $ФЗ = 5 - 2 - 4/2 = +1$. - Атом азота образует 1 одинарную связь и имеет две неподеленные электронные пары.
Число неподеленных электронов $N = 4$.
Число связывающих электронов $B = 1 \times 2 = 2$.
Формальный заряд: $ФЗ = 5 - 4 - 2/2 = 0$.
Ответ: +1, 0, +1, 0.
г) Расчет формальных зарядов для атомов хлора:
- Атом хлора образует 2 одинарные связи и имеет две неподеленные электронные пары.
Число неподеленных электронов $N = 4$.
Число связывающих электронов $B = 2 \times 2 = 4$.
Формальный заряд: $ФЗ = 7 - 4 - 4/2 = +1$. - Атом хлора образует 1 одинарную связь и имеет три неподеленные электронные пары.
Число неподеленных электронов $N = 6$.
Число связывающих электронов $B = 1 \times 2 = 2$.
Формальный заряд: $ФЗ = 7 - 6 - 2/2 = 0$. - Атом хлора не образует связей и имеет четыре неподеленные электронные пары (хлорид-ион).
Число неподеленных электронов $N = 8$.
Число связывающих электронов $B = 0$.
Формальный заряд: $ФЗ = 7 - 8 - 0/2 = -1$.
Ответ: +1, 0, -1.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 96 расположенного на странице 23 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №96 (с. 23), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















