Номер 102, страница 24 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 1. Основные понятия органической химии. 1.3. Электронное строение атома углерода. Электронные эффекты в органической химии. Уровень 2 - номер 102, страница 24.
№102 (с. 24)
Условие. №102 (с. 24)
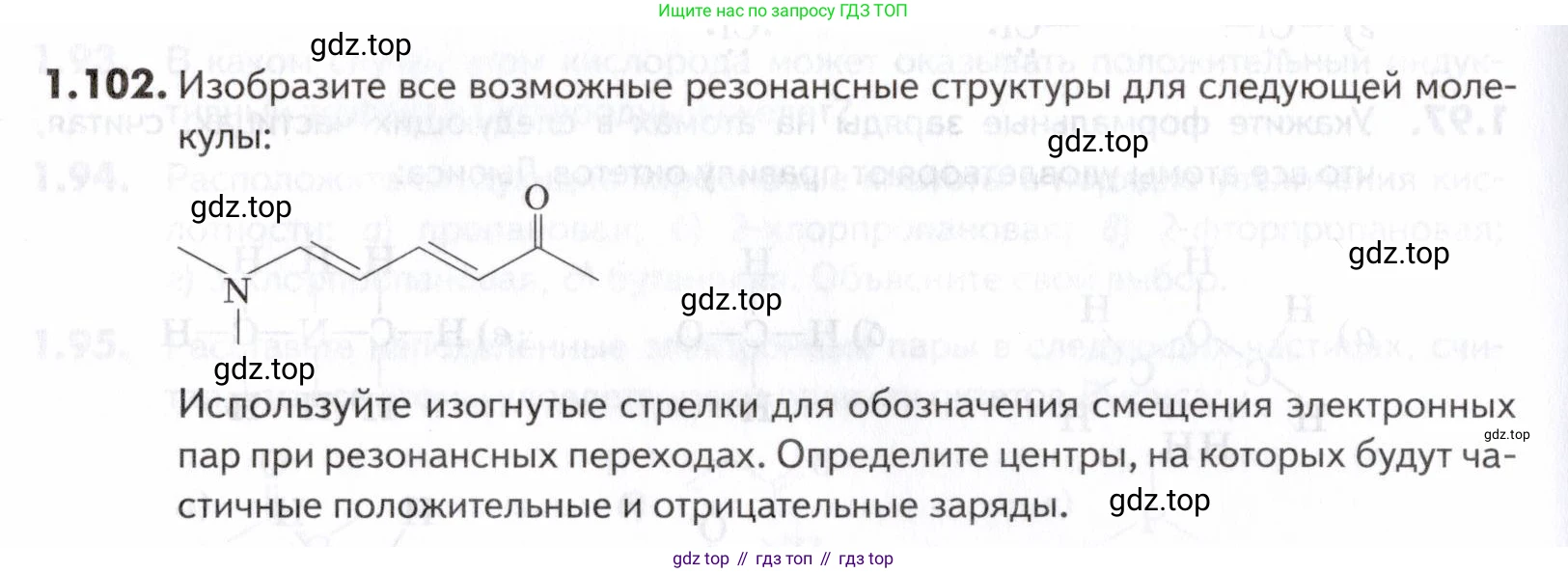
1.102. Изобразите все возможные резонансные структуры для следующей молекулы:
Используйте изогнутые стрелки для обозначения смещения электронных пар при резонансных переходах. Определите центры, на которых будут частичные положительные и отрицательные заряды.
Решение. №102 (с. 24)
Решение 3. №102 (с. 24)
Решение
Исходная молекула, 6-(диметиламино)гекса-3,5-диен-2-он, представляет собой сопряженную систему, включающую неподеленную электронную пару атома азота (электронодонорная группа) и карбонильную группу (электроноакцепторная группа), разделенные двумя сопряженными двойными связями. Такое строение приводит к значительной делокализации электронной плотности, которую можно описать с помощью набора резонансных структур.
Для удобства пронумеруем атомы углерода основной цепи, начиная от метильной группы, ближайшей к карбонилу:$$ \ce{(CH3)2N-\underset{6}{C}H=\underset{5}{C}H-\underset{4}{C}H=\underset{3}{C}H-\underset{2}{C}(=O)-\underset{1}{C}H3} $$
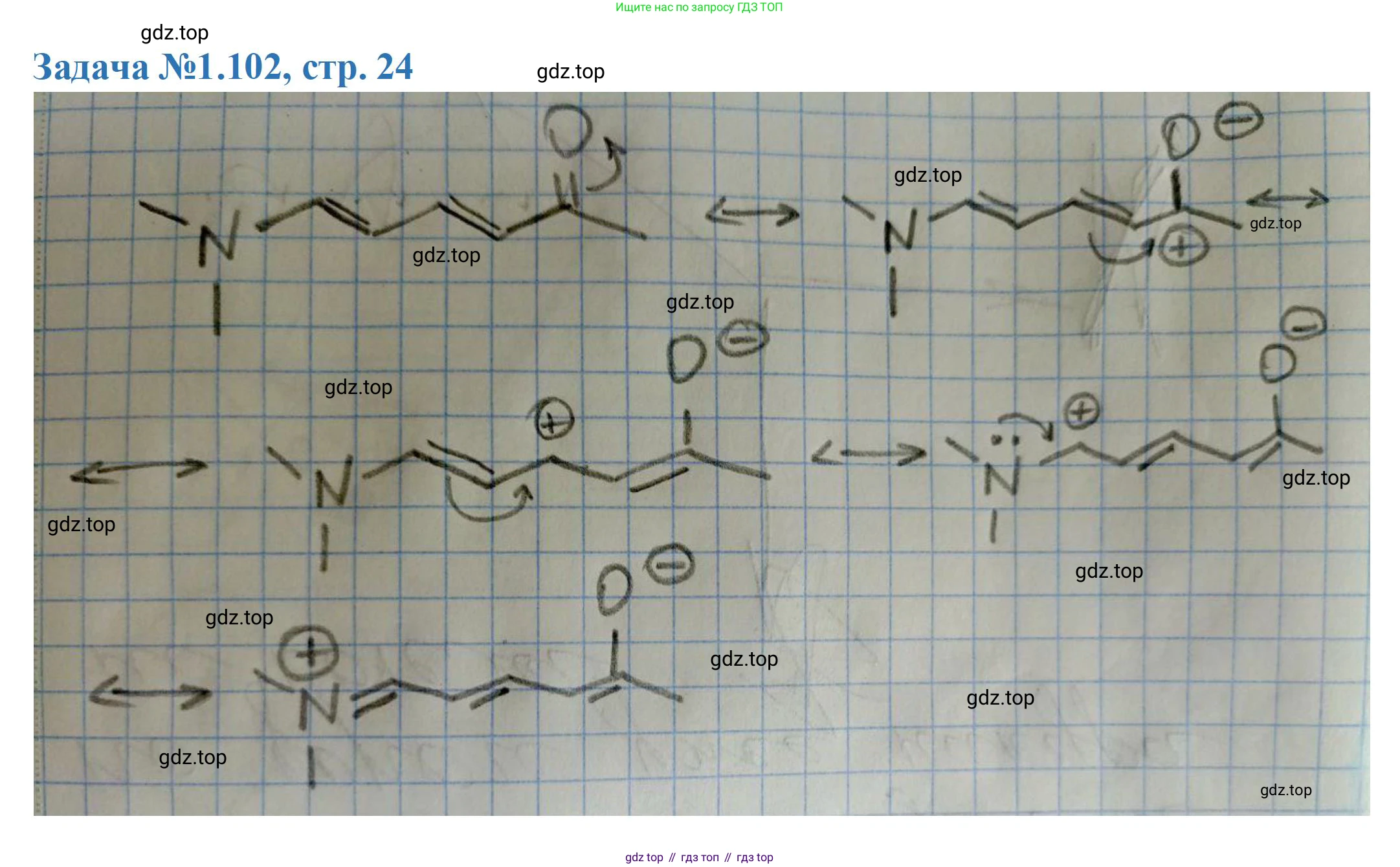
Изображение резонансных структур
Наибольший вклад в резонансный гибрид вносит структура I, так как в ней отсутствуют формальные заряды, и все атомы второго периода имеют завершенный электронный октет. Изогнутые стрелки используются для обозначения смещения электронных пар.
Структура I (основная):$$ \ce{\underset{I}{(CH3)2\overset{..}{N}-CH=CH-CH=CH-C(=\overset{..}{O})CH3}} $$
Движение электронов начинается от наиболее сильного донора — неподеленной пары атома азота. Изогнутая стрелка показывает, как эта пара образует новую $\pi$-связь $\ce{N=C6}$. Это выталкивает электроны $\pi$-связи $\ce{C5=C6}$ на атом C5, создавая карбанион. Так образуется структура II.
Структура II:$$ \ce{\underset{II}{(CH3)2\overset{+}{N}=CH-\overset{-}{C}H-CH=CH-C(=O)CH3}} $$
Отрицательный заряд на атоме C5 может быть далее делокализован. Изогнутая стрелка от отрицательного заряда на C5 показывает образование новой $\pi$-связи $\ce{C4=C5}$, что выталкивает электроны $\pi$-связи $\ce{C3=C4}$ на атом C3. Так образуется структура III.
Структура III:$$ \ce{\underset{III}{(CH3)2\overset{+}{N}=CH-CH=CH-\overset{-}{C}H-C(=O)CH3}} $$
Наконец, отрицательный заряд с атома C3 смещается для образования $\pi$-связи $\ce{C2=C3}$, а электроны $\pi$-связи карбонильной группы $\ce{C=O}$ перемещаются на более электроотрицательный атом кислорода. Это приводит к структуре IV, которая также является важным вкладчиком, так как отрицательный заряд находится на атоме кислорода, а все атомы имеют октеты.
Структура IV:$$ \ce{\underset{IV}{(CH3)2\overset{+}{N}=CH-CH=CH-CH=C(\overset{-}{O})CH3}} $$
Полная последовательность основных резонансных структур выглядит так:$$ \ce{\underset{I}{(CH3)2N-CH=CH-CH=CH-C(=O)CH3} \leftrightarrow \underset{II}{(CH3)2\overset{+}{N}=CH-\overset{-}{C}H-CH=CH-C(=O)CH3} \leftrightarrow \underset{III}{(CH3)2\overset{+}{N}=CH-CH=CH-\overset{-}{C}H-C(=O)CH3} \leftrightarrow \underset{IV}{(CH3)2\overset{+}{N}=CH-CH=CH-CH=C(\overset{-}{O})CH3}} $$
Определение центров с частичными зарядами
Реальная молекула является гибридом всех этих структур. Частичные заряды на атомах определяются вкладом каждой структуры.
- Атом азота несет формальный положительный заряд в структурах II, III и IV. Следовательно, в гибриде он будет иметь частичный положительный заряд ($δ+$).
- Атом кислорода несет формальный отрицательный заряд в структуре IV и является наиболее электроотрицательным атомом. Он будет иметь значительный частичный отрицательный заряд ($δ-$).
- Атом углерода C5 несет отрицательный заряд в структуре II. Он будет иметь частичный отрицательный заряд ($δ-$).
- Атом углерода C3 несет отрицательный заряд в структуре III. Он также будет иметь частичный отрицательный заряд ($δ-$).
- Карбонильный атом углерода C2 связан с сильно электроотрицательным кислородом, что делает его электрофильным. Он несет частичный положительный заряд ($δ+$).
Ответ:
Все возможные значимые резонансные структуры для данной молекулы:$$ \ce{\underset{I}{(CH3)2N-CH=CH-CH=CH-C(=O)CH3} \leftrightarrow \underset{II}{(CH3)2\overset{+}{N}=CH-\overset{-}{C}H-CH=CH-C(=O)CH3} \leftrightarrow \underset{III}{(CH3)2\overset{+}{N}=CH-CH=CH-\overset{-}{C}H-C(=O)CH3} \leftrightarrow \underset{IV}{(CH3)2\overset{+}{N}=CH-CH=CH-CH=C(\overset{-}{O})CH3}} $$
Центры, на которых будут частичные заряды:
- Частичные положительные заряды ($δ+$): атом азота (N) и атом углерода C2 (карбонильный).
- Частичные отрицательные заряды ($δ-$): атом кислорода (O), атом углерода C3 и атом углерода C5.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 102 расположенного на странице 24 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №102 (с. 24), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















