Номер 97, страница 23 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 1. Основные понятия органической химии. 1.3. Электронное строение атома углерода. Электронные эффекты в органической химии. Уровень 2 - номер 97, страница 23.
№97 (с. 23)
Условие. №97 (с. 23)
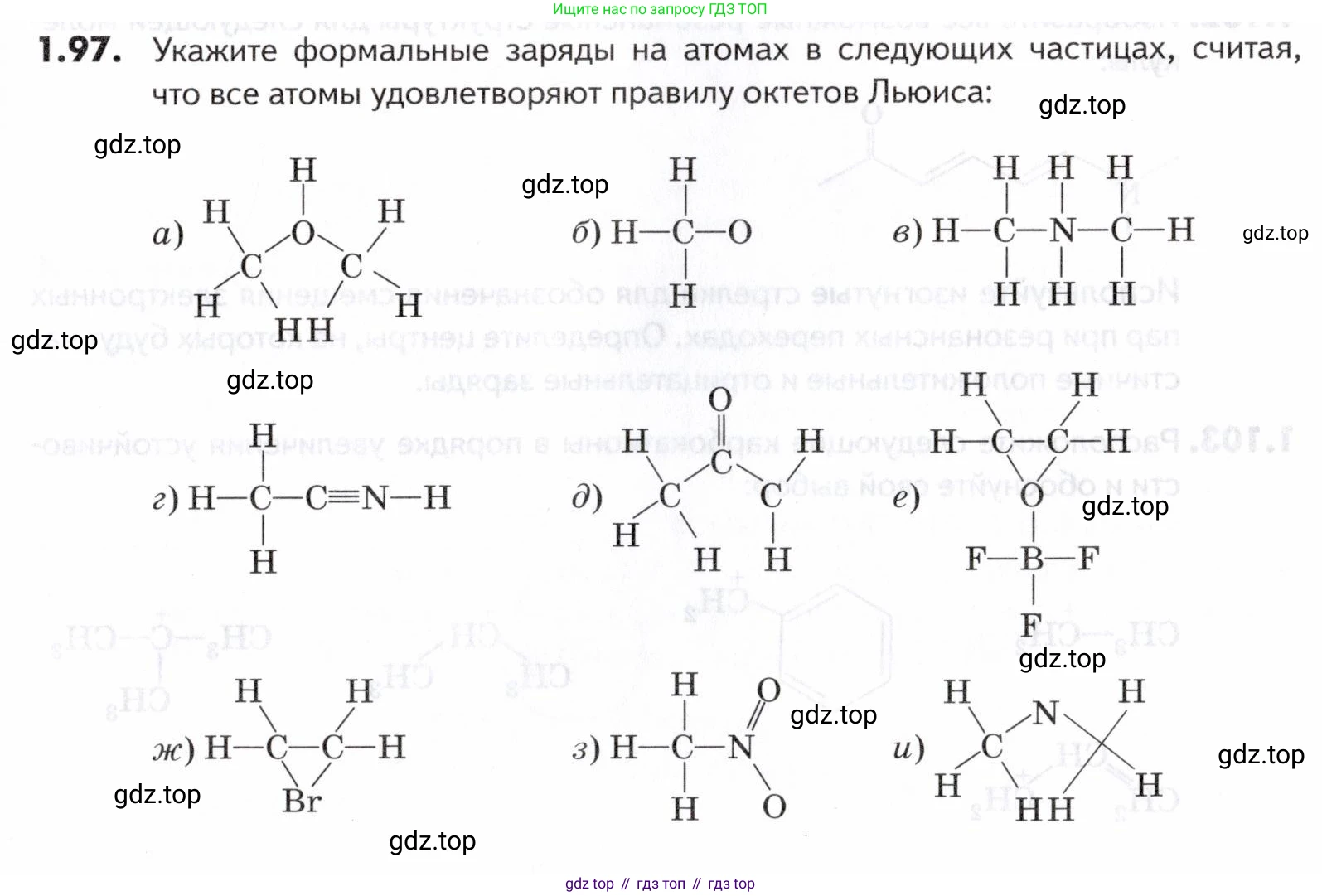
1.97. Укажите формальные заряды на атомах в следующих частицах, считая что все атомы удовлетворяют правилу октетов Льюиса:
Решение. №97 (с. 23)
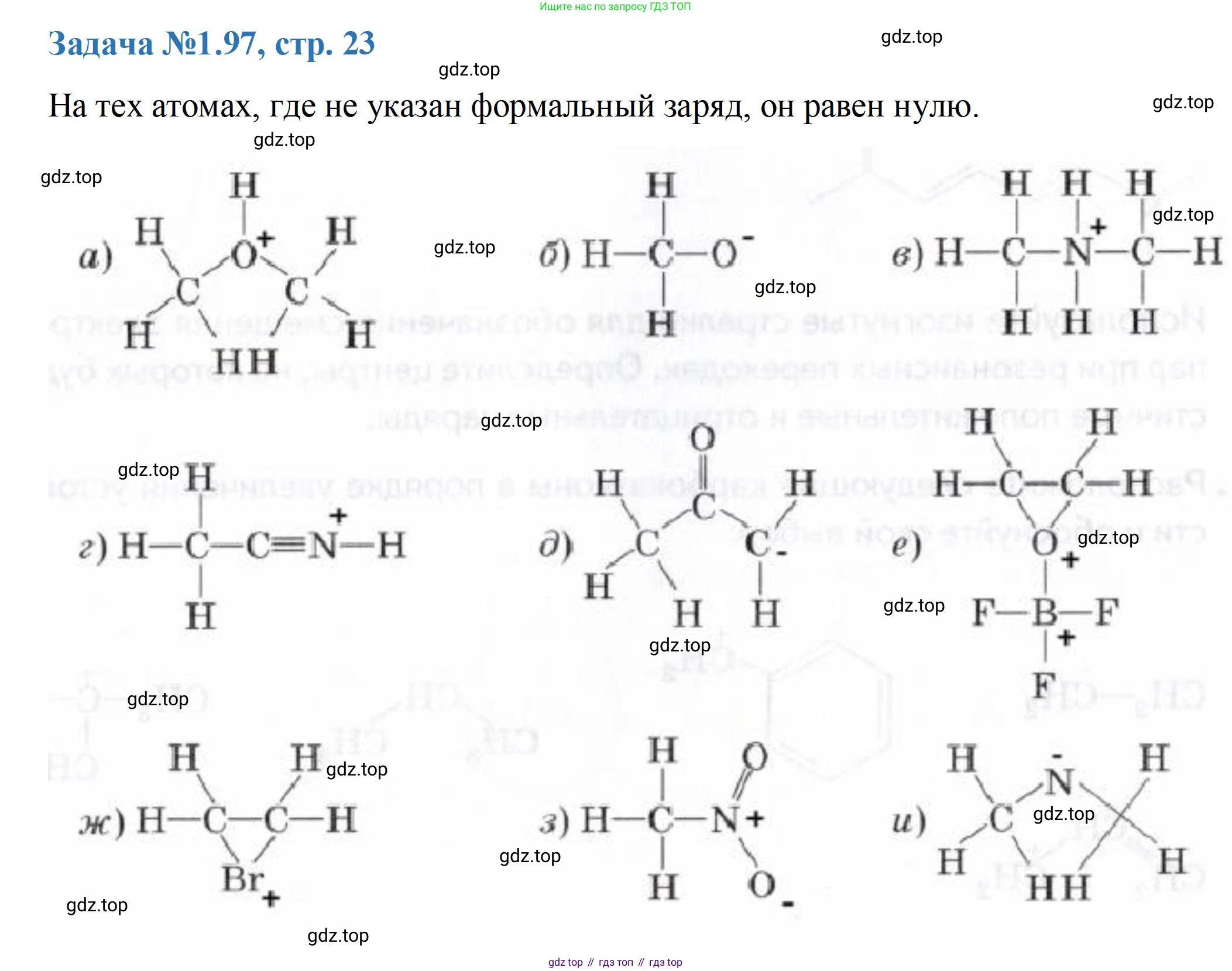
Решение 3. №97 (с. 23)
Для определения формальных зарядов используется формула:
Формальный заряд = (Число валентных электронов нейтрального атома) - (Число электронов в неподеленных парах) - 1/2 * (Число электронов в ковалентных связях)
Формулу можно записать как: $ФЗ = V - L - S/2$, где:
$V$ - число валентных электронов атома в свободном состоянии (равно номеру группы для элементов главных подгрупп).
$L$ - число электронов в неподеленных (несвязывающих) парах у данного атома.
$S$ - число электронов в ковалентных связях, образованных данным атомом (каждая связь - 2 электрона).
Условие задачи требует, чтобы все атомы (кроме водорода) удовлетворяли правилу октетов, то есть имели 8 электронов на валентной оболочке. Водород удовлетворяет правилу дуплета (2 электрона).
а) Частица представляет собой протонированную форму диметилового эфира, катион диметилоксония $(CH_3)_2OH^+$. Чтобы все атомы удовлетворяли правилу октета, необходимо дорисовать неподеленные электронные пары.
- Атомы углерода $(C)$ образуют по 4 связи (три с $H$ и одну с $O$). У них нет неподеленных пар. Валентных электронов $V_C = 4$. Число связывающих электронов $S_C = 8$.
$ФЗ(C) = 4 - 0 - 8/2 = 0$. - Атом кислорода $(O)$ образует 3 связи (две с $C$ и одну с $H$). Для соблюдения правила октета он должен иметь одну неподеленную пару электронов (3 связи × 2e⁻ + 1 пара × 2e⁻ = 8e⁻). Валентных электронов $V_O = 6$. Число электронов в неподеленной паре $L_O = 2$. Число связывающих электронов $S_O = 6$.
$ФЗ(O) = 6 - 2 - 6/2 = +1$. - Атомы водорода $(H)$ образуют по одной связи. $ФЗ(H) = 0$.
Ответ: Формальный заряд $+1$ на атоме кислорода.
б) Структура показана как $H_2C-O$. Чтобы оба атома, углерод и кислород, удовлетворяли правилу октета, им необходимо добавить неподеленные электронные пары.
- Атом углерода $(C)$ образует 3 связи (две с $H$ и одну с $O$). Для октета ему необходима одна неподеленная пара электронов (3 связи × 2e⁻ + 1 пара × 2e⁻ = 8e⁻). Валентных электронов $V_C = 4$. Число электронов в неподеленной паре $L_C = 2$. Число связывающих электронов $S_C = 6$.
$ФЗ(C) = 4 - 2 - 6/2 = -1$. - Атом кислорода $(O)$ образует 1 связь (с $C$). Для октета ему необходимо три неподеленные пары электронов (1 связь × 2e⁻ + 3 пары × 2e⁻ = 8e⁻). Валентных электронов $V_O = 6$. Число электронов в неподеленных парах $L_O = 6$. Число связывающих электронов $S_O = 2$.
$ФЗ(O) = 6 - 6 - 2/2 = -1$.
Ответ: Формальный заряд $-1$ на атоме углерода и $-1$ на атоме кислорода.
в) Частица является катионом диметиламмония $[(CH_3)_2NH_2]^+$, который образуется при протонировании диметиламина.
- Атом азота $(N)$ образует 4 связи (две с $C$ и две с $H$). Для удовлетворения правила октета у него не должно быть неподеленных пар (4 связи × 2e⁻ = 8e⁻). Валентных электронов $V_N = 5$. Число электронов в неподеленных парах $L_N = 0$. Число связывающих электронов $S_N = 8$.
$ФЗ(N) = 5 - 0 - 8/2 = +1$. - Атомы углерода и водорода имеют нулевые формальные заряды, так как образуют 4 и 1 связь соответственно.
Ответ: Формальный заряд $+1$ на атоме азота.
г) Частица представляет собой протонированный ацетонитрил $[CH_3C≡NH]^+$.
- Атом азота $(N)$ образует тройную связь с одним атомом углерода и одинарную связь с атомом водорода (всего 4 ковалентные связи). Для правила октета у него нет неподеленных пар. Валентных электронов $V_N = 5$. Число связывающих электронов $S_N = 8$.
$ФЗ(N) = 5 - 0 - 8/2 = +1$. - Атомы углерода (оба) образуют по 4 связи. Их формальные заряды равны нулю.
- Атомы водорода образуют по одной связи, их формальные заряды равны нулю.
Ответ: Формальный заряд $+1$ на атоме азота.
д) Изображение этой структуры, по-видимому, содержит опечатку. Наиболее вероятная химически корректная частица, которая может быть представлена похожим набором атомов и удовлетворяет правилу октета, — это енолят-ион ацетона $[CH_3C(O)CH_2]^-$.
- Атом углерода метиленовой группы $(CH_2)$ связан с карбонильным углеродом и двумя атомами водорода (3 связи). Для соблюдения правила октета он должен иметь одну неподеленную пару электронов. Валентных электронов $V_C = 4$. Число электронов в неподеленной паре $L_C = 2$. Число связывающих электронов $S_C = 6$.
$ФЗ(C_{CH_2}) = 4 - 2 - 6/2 = -1$. - Карбонильный атом углерода $(C=O)$ образует 4 связи, его формальный заряд 0.
- Атом кислорода $(O)$ образует двойную связь и имеет 2 неподеленные пары, его формальный заряд 0.
- Атом углерода метильной группы $(CH_3)$ образует 4 связи, его формальный заряд 0.
Ответ: Формальный заряд $-1$ на атоме углерода группы $CH_2$.
е) Частица является аддуктом оксирана (этиленоксида) и трифторида бора, $(CH_2)_2O-BF_3$. Связь $O-B$ является донорно-акцепторной, где кислород — донор, а бор — акцептор электронной пары.
- Атом кислорода $(O)$ образует 3 связи (две с $C$ и одну с $B$). Для октета он должен иметь одну неподеленную пару. Валентных электронов $V_O = 6$. Число электронов в неподеленной паре $L_O = 2$. Число связывающих электронов $S_O = 6$.
$ФЗ(O) = 6 - 2 - 6/2 = +1$. - Атом бора $(B)$ образует 4 связи (три с $F$ и одну с $O$). У него нет неподеленных пар. Валентных электронов $V_B = 3$. Число связывающих электронов $S_B = 8$.
$ФЗ(B) = 3 - 0 - 8/2 = -1$. - Атомы фтора, углерода и водорода имеют нулевые формальные заряды.
Ответ: Формальный заряд $+1$ на атоме кислорода и $-1$ на атоме бора.
ж) Частица представляет собой циклический катион бромония $[C_2H_4Br]^+$, образующийся, например, при присоединении $Br^+$ к этилену.
- Атом брома $(Br)$ образует 2 связи с атомами углерода. Чтобы удовлетворить правилу октета, он должен иметь 2 неподеленные электронные пары (2 связи × 2e⁻ + 2 пары × 2e⁻ = 8e⁻). Валентных электронов $V_{Br} = 7$. Число электронов в неподеленных парах $L_{Br} = 4$. Число связывающих электронов $S_{Br} = 4$.
$ФЗ(Br) = 7 - 4 - 4/2 = +1$. - Атомы углерода и водорода имеют нулевые формальные заряды.
Ответ: Формальный заряд $+1$ на атоме брома.
з) Частица представляет собой нитрометан, $CH_3NO_2$. Общепринятая структура Льюиса для нитрогруппы включает разделение зарядов для удовлетворения правила октета.
- Атом азота $(N)$ связан с атомом углерода, одним атомом кислорода двойной связью и другим атомом кислорода одинарной связью. Это эквивалентно 4 ковалентным связям, поэтому у него нет неподеленных пар. Валентных электронов $V_N = 5$. Число связывающих электронов $S_N = 8$.
$ФЗ(N) = 5 - 0 - 8/2 = +1$. - Атом кислорода, связанный двойной связью $(O=)$, имеет 2 неподеленные пары. Валентных электронов $V_O = 6$. Число электронов в неподеленных парах $L_O = 4$. Число связывающих электронов $S_O = 4$.
$ФЗ(O=) = 6 - 4 - 4/2 = 0$. - Атом кислорода, связанный одинарной связью $(O-)$, для октета должен иметь 3 неподеленные пары. Валентных электронов $V_O = 6$. Число электронов в неподеленных парах $L_O = 6$. Число связывающих электронов $S_O = 2$.
$ФЗ(O-) = 6 - 6 - 2/2 = -1$. - Атом углерода и атомы водорода имеют нулевые формальные заряды.
Ответ: Формальный заряд $+1$ на атоме азота и $-1$ на атоме кислорода, связанном одинарной связью.
и) Частица представляет собой азиридин (этиленимин), трехчленный гетероцикл состава $C_2H_5N$. Это нейтральная молекула.
- Атом азота $(N)$ образует 3 связи (две с $C$ и одну с $H$). Для соблюдения правила октета он должен иметь одну неподеленную пару электронов. Валентных электронов $V_N = 5$. Число электронов в неподеленной паре $L_N = 2$. Число связывающих электронов $S_N = 6$.
$ФЗ(N) = 5 - 2 - 6/2 = 0$. - Каждый атом углерода $(C)$ образует 4 связи (две с $H$, одну с другим $C$ и одну с $N$). Их формальные заряды равны нулю.
- Атомы водорода образуют по одной связи, их формальные заряды также равны нулю.
Ответ: Все атомы в молекуле имеют нулевой формальный заряд.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 97 расположенного на странице 23 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №97 (с. 23), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















