Номер 205, страница 214 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 7. Элементы-неметаллы и их соединения. 7.3. Элементы V группы. 7.3.1. Азот. Уровень 1 - номер 205, страница 214.
№205 (с. 214)
Условие. №205 (с. 214)
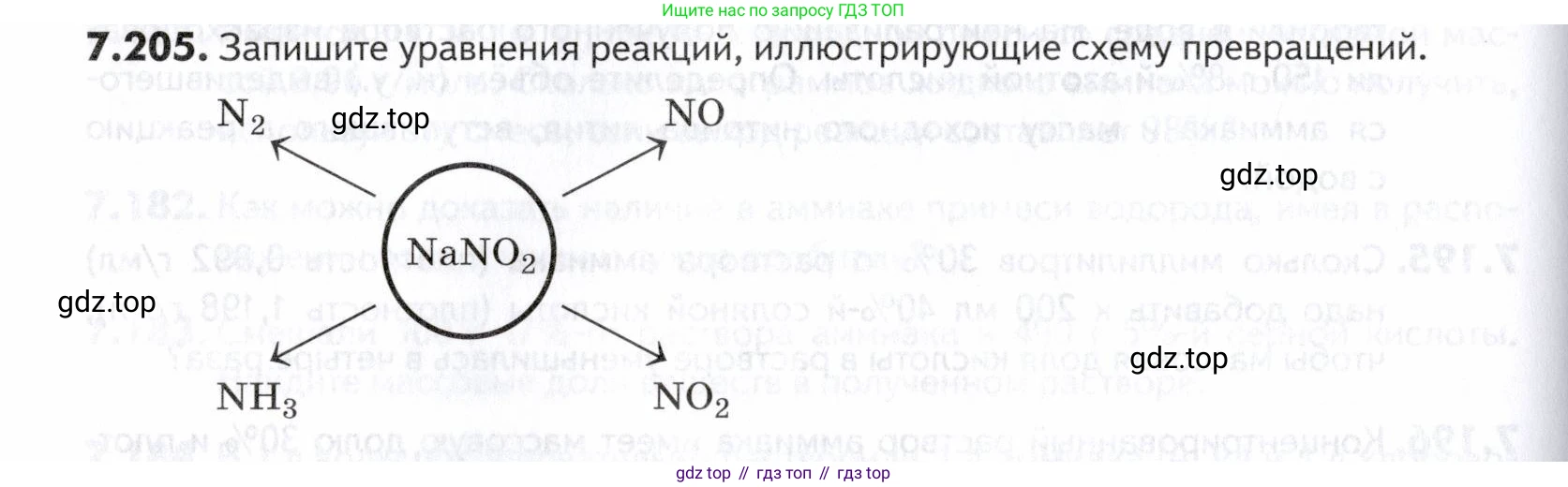
7.205. Запишите уравнения реакций, иллюстрирующие схему превращений.
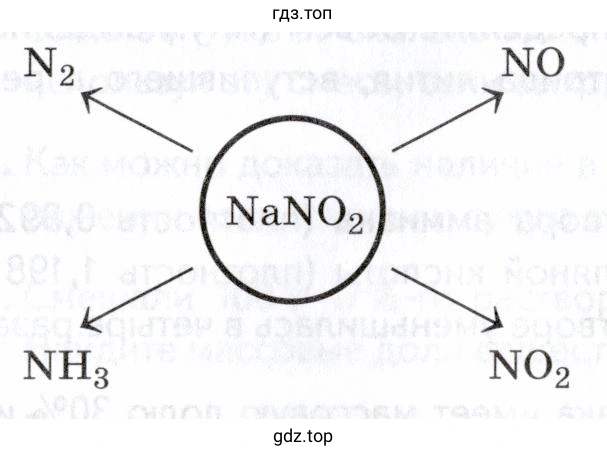
Решение 3. №205 (с. 214)
Для осуществления указанных превращений, исходя из нитрита натрия ($NaNO_2$), можно провести следующие химические реакции:
N2
Для получения молекулярного азота ($N_2$) из нитрита натрия можно использовать реакцию с солью аммония, например, хлоридом аммония ($NH_4Cl$), при нагревании. В этой реакции происходит сопропорционирование: азот в степени окисления +3 (в нитрите) и азот в степени окисления -3 (в ионе аммония) переходят в степень окисления 0.
$NaNO_2 + NH_4Cl \xrightarrow{t} N_2\uparrow + NaCl + 2H_2O$
Ответ: $NaNO_2 + NH_4Cl \xrightarrow{t} N_2\uparrow + NaCl + 2H_2O$
NO
Оксид азота(II) ($NO$) можно получить, используя нитрит натрия в качестве окислителя в кислой среде. В качестве восстановителя можно взять иодид калия ($KI$), а в качестве кислой среды — серную кислоту ($H_2SO_4$). Азот восстанавливается со степени окисления +3 до +2.
$2NaNO_2 + 2KI + 2H_2SO_4 \rightarrow 2NO\uparrow + I_2\downarrow + Na_2SO_4 + K_2SO_4 + 2H_2O$
Ответ: $2NaNO_2 + 2KI + 2H_2SO_4 \rightarrow 2NO\uparrow + I_2\downarrow + Na_2SO_4 + K_2SO_4 + 2H_2O$
NO2
Для получения оксида азота(IV) ($NO_2$), нитрит натрия должен выступить в роли восстановителя. Это происходит, например, в реакции с сильным окислителем, таким как концентрированная азотная кислота ($HNO_3$). В этой сложной окислительно-восстановительной реакции азот из нитрита (+3) и азот из азотной кислоты (+5) образуют продукты с другими степенями окисления, включая $NO_2$ (+4).
$NaNO_2 + 2HNO_3(конц.) \rightarrow NaNO_3 + 2NO_2\uparrow + H_2O$
Ответ: $NaNO_2 + 2HNO_3(конц.) \rightarrow NaNO_3 + 2NO_2\uparrow + H_2O$
NH3
Получение аммиака ($NH_3$) из нитрита натрия требует глубокого восстановления азота со степени окисления +3 до -3. Это достигается с помощью сильных восстановителей, таких как металлический алюминий ($Al$) или цинк ($Zn$), в щелочной среде (раствор $NaOH$).
$NaNO_2 + 2Al + NaOH + 5H_2O \rightarrow NH_3\uparrow + 2Na[Al(OH)_4]$
В данной реакции алюминий окисляется, образуя комплексную соль — тетрагидроксоалюминат натрия, а азот восстанавливается до аммиака.
Ответ: $NaNO_2 + 2Al + NaOH + 5H_2O \rightarrow NH_3\uparrow + 2Na[Al(OH)_4]$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 205 расположенного на странице 214 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №205 (с. 214), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















