Номер 98, страница 262 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 10. Строение вещества. 10.1. Строение атома и Периодический закон. 10.1.2. Электронная конфигурация атома. Уровень 2 - номер 98, страница 262.
№98 (с. 262)
Условие. №98 (с. 262)
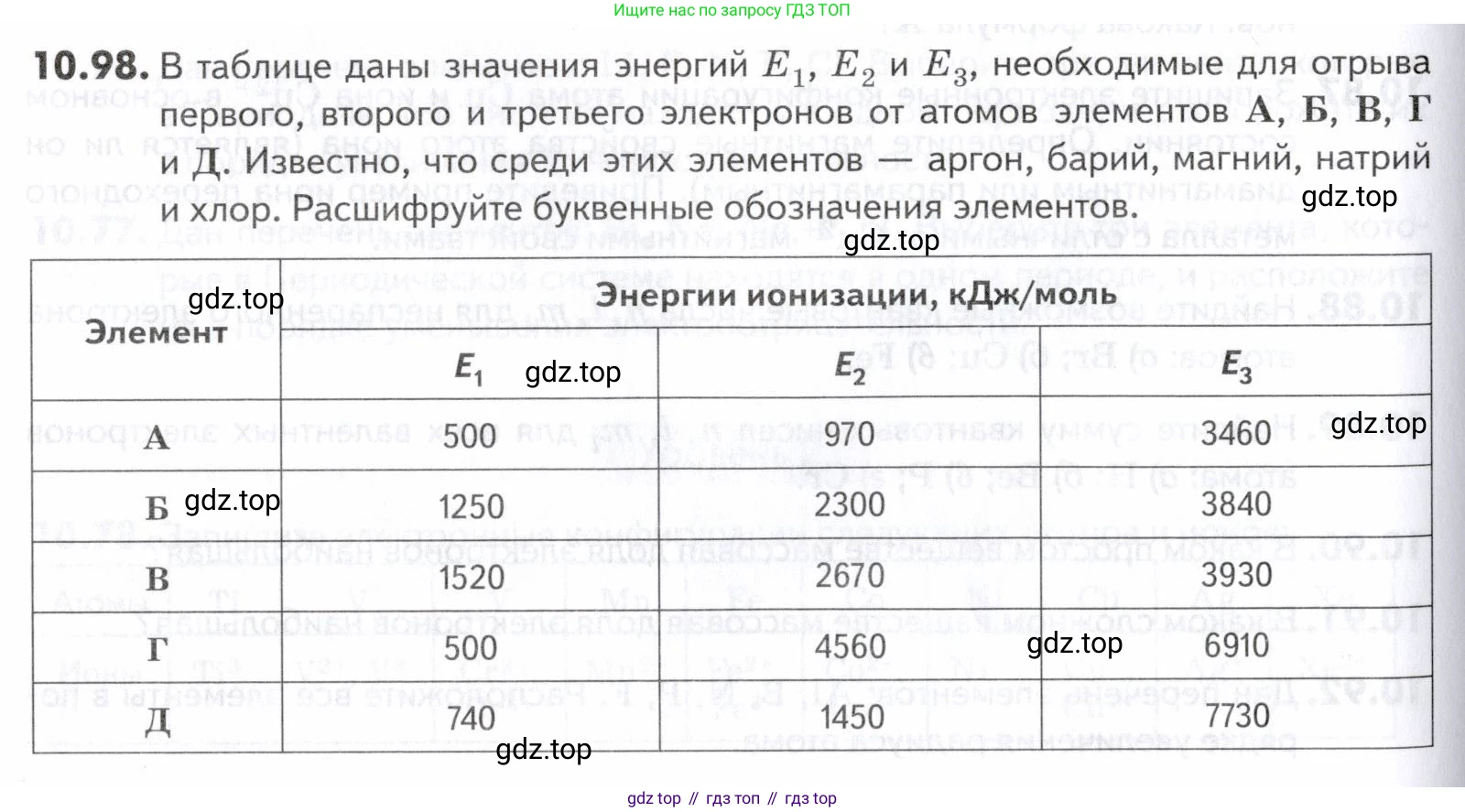
10.98. В таблице даны значения энергий и необходимые для отрыва первого, второго и третьего электронов от атомов элементов А, Б, В, Г и Д. Известно, что среди этих элементов – аргон, барий, магний, натрий и хлор. Расшифруйте буквенные обозначения элементов.
| Элемент | Энергии ионизации, кДж/моль | ||
| А | 500 | 970 | 3460 |
| Б | 1250 | 2300 | 3840 |
| В | 1520 | 2670 | 3930 |
| Г | 500 | 4560 | 6910 |
| Д | 740 | 1450 | 7730 |
Решение 3. №98 (с. 262)
Дано:
Энергии ионизации $E_1$, $E_2$, $E_3$ (в кДж/моль) для пяти неизвестных элементов А, Б, В, Г и Д:
А: $E_1=500$, $E_2=970$, $E_3=3460$
Б: $E_1=1250$, $E_2=2300$, $E_3=3840$
В: $E_1=1520$, $E_2=2670$, $E_3=3930$
Г: $E_1=500$, $E_2=4560$, $E_3=6910$
Д: $E_1=740$, $E_2=1450$, $E_3=7730$
Список возможных элементов: аргон (Ar), барий (Ba), магний (Mg), натрий (Na), хлор (Cl).
Найти:
Расшифровать буквенные обозначения элементов.
Решение:
Для определения элементов будем анализировать значения их последовательных энергий ионизации. Ключевым фактором является резкое увеличение энергии ионизации при переходе к отрыву электрона от стабильного, заполненного электронного слоя (внутренней оболочки). Это позволяет определить количество валентных электронов у атома и, соответственно, его положение (группу) в периодической системе.
Рассмотрим электронные конфигурации и ожидаемые скачки энергий ионизации для предложенных элементов:
- Натрий (Na): [Ne]3s¹. 1 валентный электрон. Ожидается очень большой скачок между $E_1$ и $E_2$.
- Магний (Mg): [Ne]3s². 2 валентных электрона. Ожидается очень большой скачок между $E_2$ и $E_3$.
- Барий (Ba): [Xe]6s². 2 валентных электрона. Как и у магния, ожидается скачок между $E_2$ и $E_3$. Поскольку атомный радиус бария больше, чем у магния, его первые энергии ионизации будут ниже.
- Хлор (Cl): [Ne]3s²3p⁵. 7 валентных электронов. Первые три электрона отрываются от одного и того же валентного (третьего) уровня, поэтому резких скачков между $E_1$, $E_2$ и $E_3$ не будет.
- Аргон (Ar): [Ne]3s²3p⁶. 8 валентных электронов (завершенная оболочка). Будет иметь самую высокую первую энергию ионизации ($E_1$) среди элементов 3-го периода (Na, Mg, Cl, Ar). Резких скачков между $E_1$, $E_2$ и $E_3$ также не будет.
Теперь сопоставим данные из таблицы с нашими выводами.
А
У элемента А наблюдается скачок между второй ($E_2=970$) и третьей ($E_3=3460$) энергиями ионизации. Это указывает на наличие двух валентных электронов, то есть элемент принадлежит ко 2-й группе. В списке это может быть магний (Mg) или барий (Ba). Первая энергия ионизации ($E_1=500$ кДж/моль) является одной из самых низких в таблице. Сравнивая с элементом Д (также элемент 2-й группы), у которого $E_1=740$ кДж/моль, можно заключить, что А — это элемент с меньшей энергией ионизации. В группе энергия ионизации уменьшается сверху вниз, поэтому у бария (период 6) она меньше, чем у магния (период 3). Следовательно, А — это барий.
Ответ: А — барий (Ba).
Б
У элемента Б относительно высокая первая энергия ионизации ($E_1=1250$ кДж/моль) и нет резких скачков между $E_1$, $E_2$ и $E_3$. Это характерно для неметалла из правой части периодической таблицы, у которого отрываются валентные электроны с одного энергетического уровня. Сравнивая с элементом В ($E_1=1520$ кДж/моль), у Б энергия ионизации ниже. Из оставшихся элементов (хлор и аргон), хлор находится левее аргона в 3-м периоде, поэтому его $E_1$ должна быть ниже. Таким образом, Б — это хлор.
Ответ: Б — хлор (Cl).
В
У элемента В самая высокая первая энергия ионизации в таблице ($E_1=1520$ кДж/моль). Это свойственно благородному газу с его очень стабильной, завершенной электронной оболочкой. Последующие энергии ионизации ($E_2=2670$, $E_3=3930$) растут плавно, без скачков, так как электроны продолжают отрываться от одного и того же валентного уровня. Единственный благородный газ в списке — аргон.
Ответ: В — аргон (Ar).
Г
У элемента Г наблюдается низкая первая энергия ионизации ($E_1=500$ кДж/моль) и колоссальный скачок ко второй ($E_2=4560$ кДж/моль). Отношение $E_2/E_1 \approx 9.1$. Это однозначно указывает на элемент 1-й группы (щелочной металл), у которого всего один валентный электрон. После его отрыва второй электрон приходится отрывать от очень стабильной внутренней электронной оболочки. Единственный щелочной металл в списке — натрий.
Ответ: Г — натрий (Na).
Д
У элемента Д наблюдается большой скачок между второй ($E_2=1450$) и третьей ($E_3=7730$) энергиями ионизации ($E_3/E_2 \approx 5.3$). Это указывает на наличие двух валентных электронов, то есть элемент принадлежит ко 2-й группе. Сравнивая с элементом А (также элемент 2-й группы), у Д более высокая первая энергия ионизации ($E_1=740$ кДж/моль против $500$ кДж/моль у А). Так как энергия ионизации в группе уменьшается сверху вниз, элемент с большей $E_1$ находится выше. Следовательно, Д — это магний, расположенный в 3-м периоде, а А — барий из 6-го периода.
Ответ: Д — магний (Mg).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 98 расположенного на странице 262 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №98 (с. 262), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















