Номер 4, страница 55 - гдз по химии 10 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: коричневый
ISBN: 978-5-09-088084-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 10 классе
Глава III. Непредельные углеводороды (алкены, алкадиены и алкины). Параграф 12. Практическая работа 2. Получение этилена и опыты с ним - номер 4, страница 55.
№4 (с. 55)
Условие. №4 (с. 55)
скриншот условия

4. Подожгите выделяющийся газ.
• Почему этилен горит более светящимся пламенем, чем метан?
• Чем отличаются свойства этилена от свойств предельных углеводородов? Напишите уравнения соответствующих реакций.
Решение. №4 (с. 55)

Решение 2. №4 (с. 55)
Почему этилен горит более светящимся пламенем, чем метан?
Свечение пламени при горении углеводородов обусловлено наличием в нем раскаленных до высоких температур твердых частиц углерода (сажи). Чем больше массовая доля углерода в молекуле горючего вещества, тем выше вероятность его неполного сгорания с образованием сажи, и, как следствие, тем более ярким и светящимся будет пламя.
Сравним массовые доли углерода ($\omega(C)$) в метане ($CH_4$) и этилене ($C_2H_4$).
Для метана ($CH_4$):
$\omega(C) = \frac{M(C)}{M(CH_4)} = \frac{12}{12 + 4 \cdot 1} = \frac{12}{16} = 0,75$ или 75%.
Для этилена ($C_2H_4$):
$\omega(C) = \frac{2 \cdot M(C)}{M(C_2H_4)} = \frac{2 \cdot 12}{2 \cdot 12 + 4 \cdot 1} = \frac{24}{28} \approx 0,857$ или 85,7%.
Массовая доля углерода в этилене значительно выше. Поэтому при его горении в воздухе, где количество кислорода ограничено, происходит неполное сгорание. Часть углерода не окисляется до $CO_2$, а выделяется в виде мелкодисперсных частиц сажи, которые, раскаляясь в пламени, создают яркое свечение. Метан, с меньшим содержанием углерода, сгорает более полно с образованием менее яркого, голубоватого пламени.
Уравнение неполного горения этилена с образованием сажи:
$C_2H_4 + O_2 \rightarrow 2C\downarrow + 2H_2O$
Ответ: Этилен горит более светящимся пламенем, чем метан, так как в молекуле этилена выше массовая доля углерода (85,7% против 75% у метана). Это приводит к его неполному сгоранию с образованием частиц сажи, которые раскаляются в пламени и вызывают яркое свечение.
Чем отличаются свойства этилена от свойств предельных углеводородов? Напишите уравнения соответствующих реакций.
Основное отличие свойств этилена от свойств предельных углеводородов (алканов) обусловлено их строением. Молекула этилена ($CH_2=CH_2$) относится к непредельным углеводородам (алкенам) и содержит одну двойную связь между атомами углерода. Предельные углеводороды, например, этан ($CH_3-CH_3$), содержат только одинарные связи.
Двойная связь состоит из одной прочной $\sigma$-связи и одной менее прочной $\pi$-связи. Наличие непрочной $\pi$-связи, которая легко разрывается, определяет высокую реакционную способность этилена. В отличие от предельных углеводородов, для которых характерны реакции замещения, для этилена и других алкенов наиболее характерны реакции присоединения, окисления и полимеризации.
1. Реакции присоединения. Происходят с разрывом $\pi$-связи. Предельные углеводороды в такие реакции не вступают.
Присоединение галогенов (например, обесцвечивание бромной воды) — качественная реакция на двойную связь:
$CH_2=CH_2 + Br_2 \rightarrow CH_2Br-CH_2Br$ (1,2-дибромэтан)
Присоединение водорода (гидрирование):
$CH_2=CH_2 + H_2 \xrightarrow{Ni, t^\circ} CH_3-CH_3$ (этан)
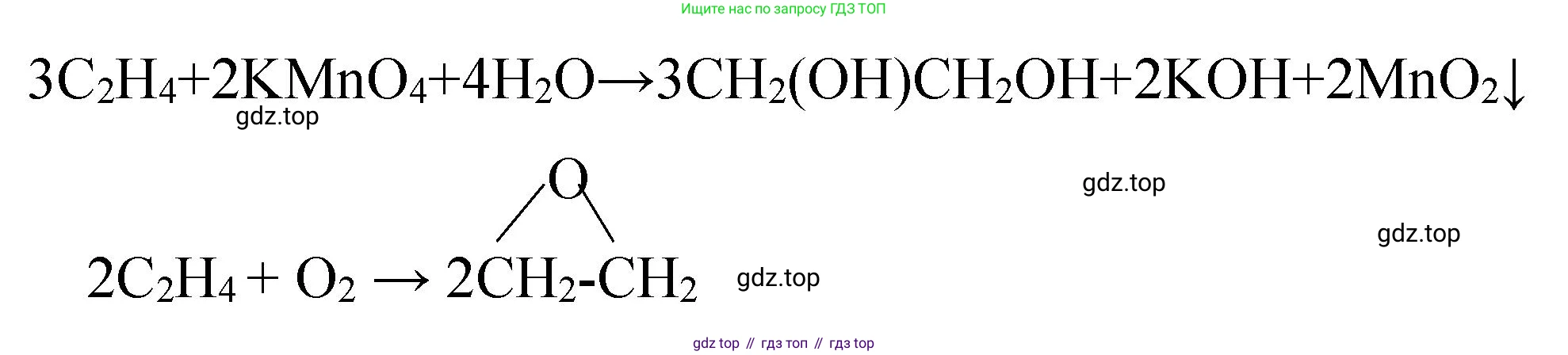
2. Реакция окисления. Этилен легко окисляется, например, раствором перманганата калия (реакция Вагнера), обесцвечивая его. Это также качественная реакция на кратную связь. Предельные углеводороды в этих условиях не окисляются.
$3CH_2=CH_2 + 2KMnO_4 + 4H_2O \rightarrow 3HOCH_2-CH_2OH + 2MnO_2\downarrow + 2KOH$ (этиленгликоль)
3. Реакция полимеризации. Молекулы этилена способны соединяться друг с другом, образуя высокомолекулярное соединение — полиэтилен. Предельные углеводороды к полимеризации не способны.
$nCH_2=CH_2 \xrightarrow{t^\circ, P, кат.} (-CH_2-CH_2-)_n$ (полиэтилен)
Для сравнения, типичная реакция для предельных углеводородов — это реакция замещения, которая протекает в жестких условиях (например, под действием УФ-света):
$CH_3-CH_3 + Cl_2 \xrightarrow{h\nu} CH_3-CH_2Cl + HCl$ (хлорэтан)
Ответ: Главное отличие свойств этилена от предельных углеводородов заключается в том, что из-за наличия двойной связи этилен вступает в реакции присоединения, легко окисляется и полимеризуется. Для предельных углеводородов, имеющих только одинарные связи, характерны реакции замещения, и они значительно менее реакционноспособны.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 4 расположенного на странице 55 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 55), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.




















