Номер 1.14, страница 39, часть II - гдз по химии 8-9 класс задачник с помощником Гара, Габрусева
Авторы: Гара Н. Н., Габрусева Н. И.
Тип: Задачник с помощником
Издательство: Просвещение
Год издания: 2009 - 2025
Часть: II
Цвет обложки: зелёный, синий
ISBN: 978-5-09-037902-1
Популярные ГДЗ в 8 классе
Часть II. Вычисления по химическим уравнениям. 1. Вычисление массы, объема или количества вещества по известной массе, объему или количеству вещества одного из вступивших в реакцию или получившихся в результате реакции веществ - номер 1.14, страница 39.
№1.14 (с. 39)
Условие. №1.14 (с. 39)
скриншот условия

1.14. Вычислите массу гидроксида кальция, образовавшегося при взаимодействии 100 г кальция с водой. Какой объем водорода выделится при этом (н. у.)?
Решение. №1.14 (с. 39)

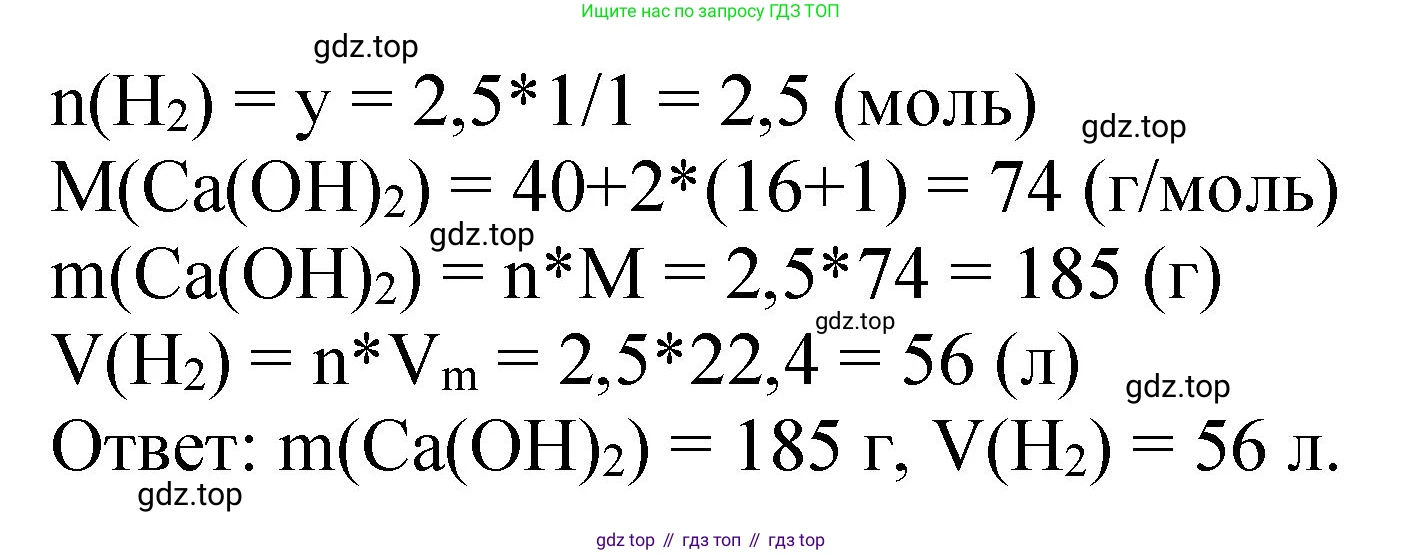
Решение 2. №1.14 (с. 39)
Дано:
m(Ca) = 100 г
Найти:
m(Ca(OH)₂) - ?
V(H₂) (н. у.) - ?
Решение:
1. Запишем уравнение химической реакции взаимодействия кальция с водой. Кальций — активный металл, который реагирует с водой с образованием гидроксида кальция и выделением водорода.
$Ca + 2H_2O \rightarrow Ca(OH)_2 + H_2 \uparrow$
2. Рассчитаем количество вещества кальция (Ca), содержащееся в 100 г. Для этого воспользуемся формулой $n = \frac{m}{M}$, где $m$ — масса вещества, а $M$ — его молярная масса.
Молярная масса кальция $M(Ca) \approx 40$ г/моль.
$n(Ca) = \frac{100 \text{ г}}{40 \text{ г/моль}} = 2.5 \text{ моль}$
3. Используя уравнение реакции, определим количество вещества продуктов реакции: гидроксида кальция $Ca(OH)_2$ и водорода $H_2$.
Согласно стехиометрическим коэффициентам в уравнении реакции, соотношение количеств веществ следующее:
$n(Ca) : n(Ca(OH)_2) : n(H_2) = 1 : 1 : 1$
Отсюда следует, что:
$n(Ca(OH)_2) = n(Ca) = 2.5 \text{ моль}$
$n(H_2) = n(Ca) = 2.5 \text{ моль}$
4. Теперь вычислим массу образовавшегося гидроксида кальция $Ca(OH)_2$ по формуле $m = n \cdot M$.
Сначала найдем молярную массу $Ca(OH)_2$:
$M(Ca(OH)_2) = M(Ca) + 2 \cdot (M(O) + M(H)) = 40 + 2 \cdot (16 + 1) = 40 + 34 = 74 \text{ г/моль}$
Рассчитаем массу гидроксида кальция:
$m(Ca(OH)_2) = 2.5 \text{ моль} \cdot 74 \text{ г/моль} = 185 \text{ г}$
5. Наконец, вычислим объем выделившегося водорода $H_2$ при нормальных условиях (н. у.). При н. у. один моль любого газа занимает объем $V_m = 22.4$ л/моль. Воспользуемся формулой $V = n \cdot V_m$.
$V(H_2) = 2.5 \text{ моль} \cdot 22.4 \text{ л/моль} = 56 \text{ л}$
Ответ: масса образовавшегося гидроксида кальция равна 185 г, объем выделившегося водорода (н. у.) равен 56 л.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8-9 класс, для упражнения номер 1.14 расположенного на странице 39 для II-й части к задачнику с помощником 2009 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1.14 (с. 39), авторов: Гара (Наталья Николаевна), Габрусева (Надежда Ивановна), II-й части учебного пособия издательства Просвещение.
















