Номер 4-15, страница 43 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2025
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 4. Газы. Кислород. Горение. 4.1. Молярный объем газов. Относительная плотность газов - номер 4-15, страница 43.
№4-15 (с. 43)
Условие. №4-15 (с. 43)
скриншот условия

4-15. В 890,5 мл воды растворили 67,2 л (н.у.) хлороводорода $HCl$. Вычислите массовую долю хлороводорода в образовавшейся соляной кислоте.
Решение. №4-15 (с. 43)
Решение 2. №4-15 (с. 43)
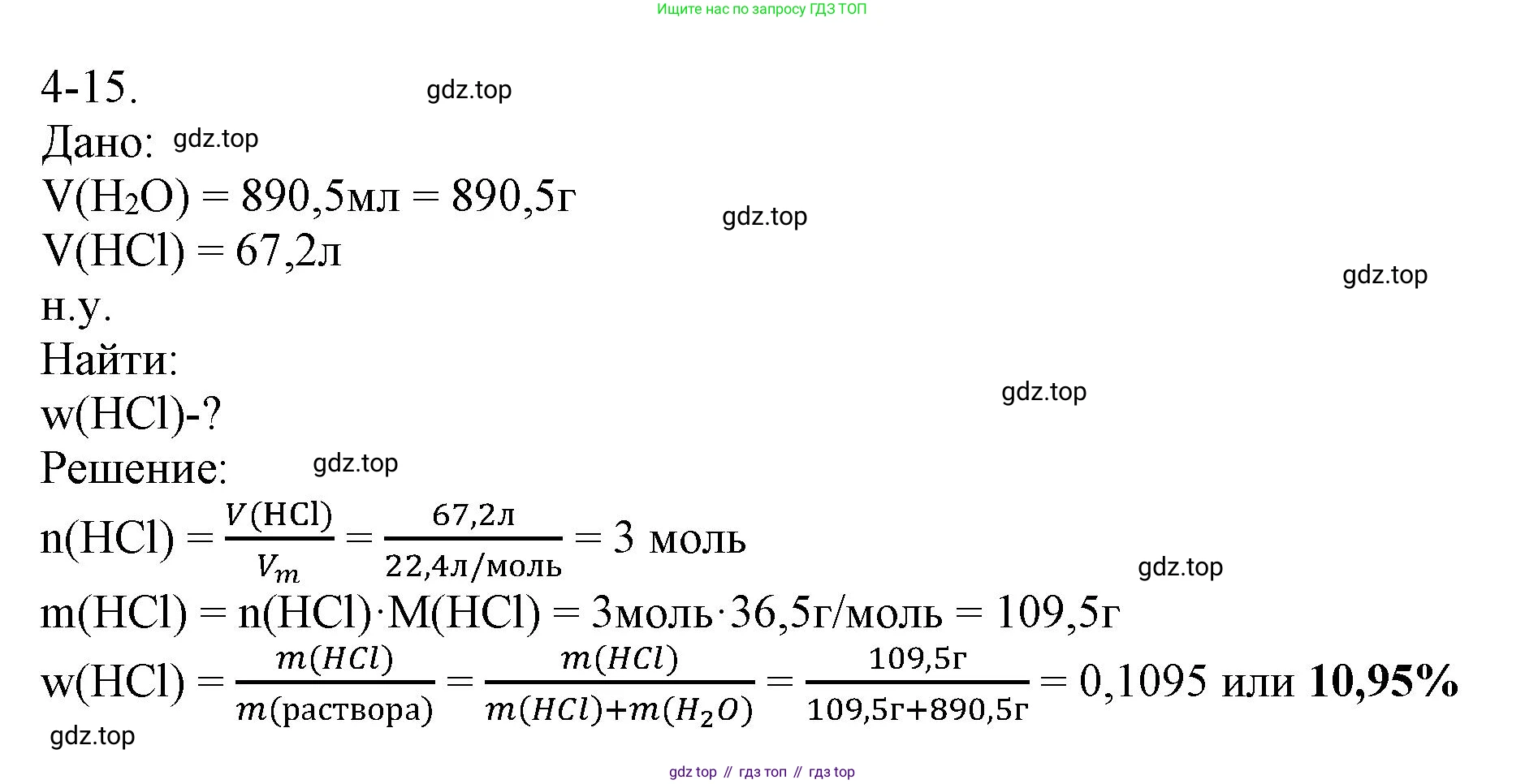
Дано:
$V(\text{H}_2\text{O}) = 890.5 \text{ мл}$
$V(\text{HCl})_{\text{н.у.}} = 67.2 \text{ л}$
Перевод данных в систему СИ:
$V(\text{H}_2\text{O}) = 890.5 \text{ мл} = 890.5 \cdot 10^{-6} \text{ м}^3$
$V(\text{HCl})_{\text{н.у.}} = 67.2 \text{ л} = 67.2 \cdot 10^{-3} \text{ м}^3 = 0.0672 \text{ м}^3$
Найти:
$\omega(\text{HCl})$ - ?
Решение:
Массовая доля вещества в растворе ($\omega$) вычисляется по формуле:
$\omega(\text{вещества}) = \frac{m(\text{вещества})}{m(\text{раствора})}$
Масса раствора представляет собой сумму масс растворителя (воды) и растворенного вещества (хлороводорода):
$m(\text{раствора}) = m(\text{H}_2\text{O}) + m(\text{HCl})$
1. Найдем массу воды ($m(\text{H}_2\text{O})$). Плотность воды ($\rho(\text{H}_2\text{O})$) принимаем равной $1 \text{ г/мл}$.
$m(\text{H}_2\text{O}) = V(\text{H}_2\text{O}) \cdot \rho(\text{H}_2\text{O}) = 890.5 \text{ мл} \cdot 1 \text{ г/мл} = 890.5 \text{ г}$
2. Найдем массу хлороводорода ($m(\text{HCl})$). Для этого сначала вычислим его количество вещества ($n$). Объем хлороводорода дан при нормальных условиях (н.у.), поэтому используем молярный объем идеального газа $V_m = 22.4 \text{ л/моль}$.
$n(\text{HCl}) = \frac{V(\text{HCl})}{V_m} = \frac{67.2 \text{ л}}{22.4 \text{ л/моль}} = 3 \text{ моль}$
Далее вычислим молярную массу хлороводорода ($M(\text{HCl})$) по периодической таблице химических элементов:
$M(\text{HCl}) = M(\text{H}) + M(\text{Cl}) = 1.0 + 35.5 = 36.5 \text{ г/моль}$
Теперь можем найти массу HCl:
$m(\text{HCl}) = n(\text{HCl}) \cdot M(\text{HCl}) = 3 \text{ моль} \cdot 36.5 \text{ г/моль} = 109.5 \text{ г}$
3. Вычислим общую массу полученного раствора соляной кислоты:
$m(\text{раствора}) = m(\text{H}_2\text{O}) + m(\text{HCl}) = 890.5 \text{ г} + 109.5 \text{ г} = 1000.0 \text{ г}$
4. Рассчитаем массовую долю хлороводорода в растворе. Для выражения в процентах, результат умножим на 100%.
$\omega(\text{HCl}) = \frac{m(\text{HCl})}{m(\text{раствора})} \cdot 100\% = \frac{109.5 \text{ г}}{1000.0 \text{ г}} \cdot 100\% = 0.1095 \cdot 100\% = 10.95\%$
Ответ: массовая доля хлороводорода в образовавшейся соляной кислоте составляет 10,95%.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 4-15 расположенного на странице 43 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4-15 (с. 43), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.
















