Номер 5-121, страница 65 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2025
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 5. Основные классы неорганических соединений. 5.5. Соли - номер 5-121, страница 65.
№5-121 (с. 65)
Условие. №5-121 (с. 65)
скриншот условия

5-121. Напишите уравнения реакций, в результате которых можно получить
а) карбонат кальция,
б) хлорид натрия.
Постарайтесь найти максимальное число принципиально разных способов.
Решение. №5-121 (с. 65)
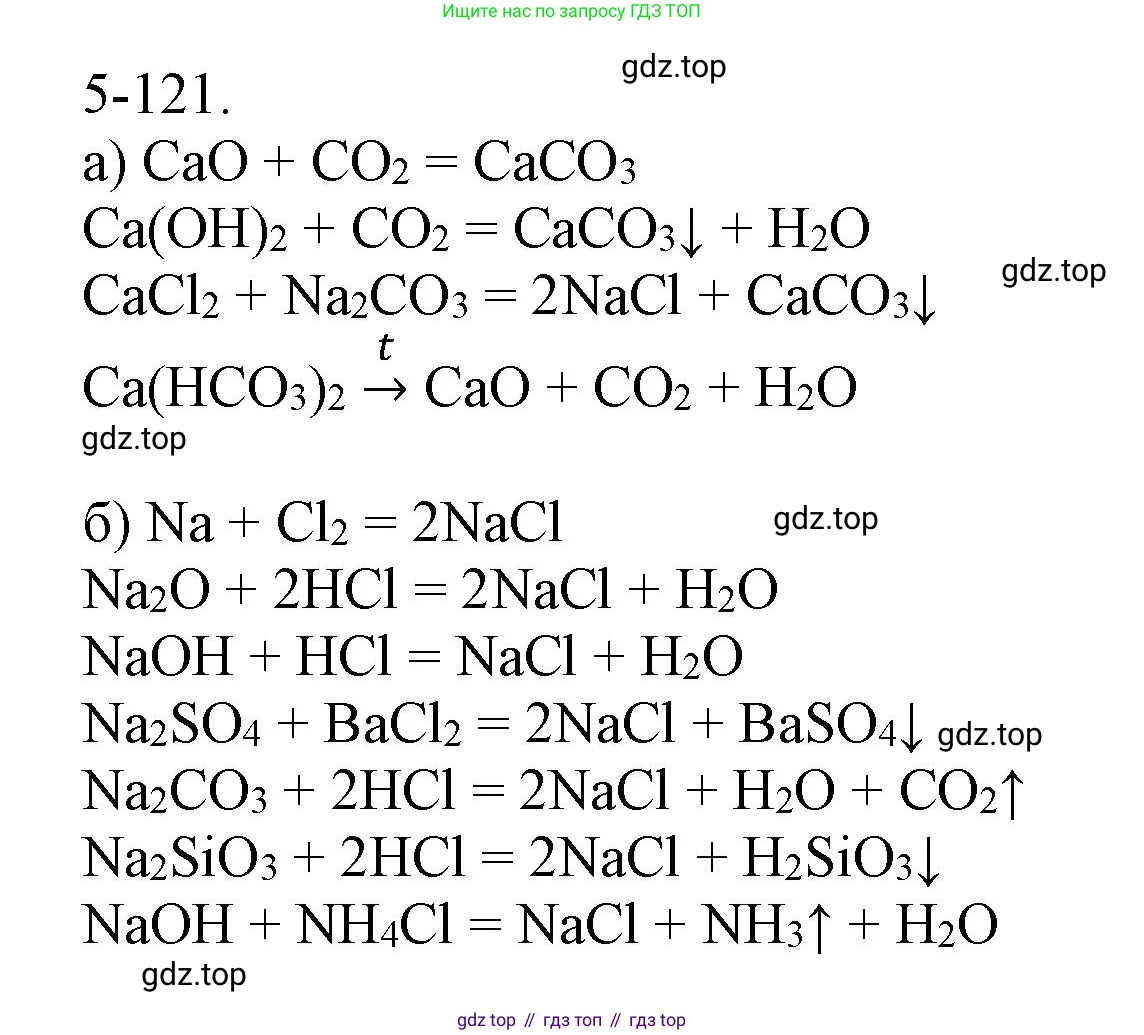
Решение 2. №5-121 (с. 65)
а) карбонат кальция
Карбонат кальция ($CaCO_3$) — это нерастворимая в воде соль. Существует несколько принципиально различных способов её получения, основанных на разных типах химических реакций.
Взаимодействие основного оксида с кислотным оксидом. Оксид кальция реагирует с диоксидом углерода:
$CaO + CO_2 \rightarrow CaCO_3$
Взаимодействие основания с кислотным оксидом. Гидроксид кальция (известковая вода) реагирует с диоксидом углерода с образованием белого осадка. Эта реакция является качественной на углекислый газ:
$Ca(OH)_2 + CO_2 \rightarrow CaCO_3 \downarrow + H_2O$
Реакция ионного обмена между двумя растворимыми солями, в результате которой образуется нерастворимый карбонат кальция:
$CaCl_2 + Na_2CO_3 \rightarrow CaCO_3 \downarrow + 2NaCl$
Термическое разложение гидрокарбоната кальция. При нагревании раствора гидрокарбоната кальция он разлагается с образованием осадка карбоната кальция (этот процесс обуславливает образование накипи):
$Ca(HCO_3)_2 \xrightarrow{t} CaCO_3 \downarrow + H_2O + CO_2 \uparrow$
Вытеснение более слабой кислоты из её соли более сильной. Угольная кислота (образующаяся из $CO_2$ и $H_2O$) сильнее кремниевой, поэтому вытесняет её из силиката кальция:
$CaSiO_3 + H_2O + CO_2 \rightarrow CaCO_3 \downarrow + H_2SiO_3 \downarrow$
Взаимодействие активного металла с кислотой. Металлический кальций реагирует с угольной кислотой:
$Ca + H_2CO_3 \rightarrow CaCO_3 \downarrow + H_2 \uparrow$
Ответ:
$CaO + CO_2 \rightarrow CaCO_3$
$Ca(OH)_2 + CO_2 \rightarrow CaCO_3 \downarrow + H_2O$
$CaCl_2 + Na_2CO_3 \rightarrow CaCO_3 \downarrow + 2NaCl$
$Ca(HCO_3)_2 \xrightarrow{t} CaCO_3 \downarrow + H_2O + CO_2 \uparrow$
$CaSiO_3 + H_2O + CO_2 \rightarrow CaCO_3 \downarrow + H_2SiO_3 \downarrow$
$Ca + H_2CO_3 \rightarrow CaCO_3 \downarrow + H_2 \uparrow$
б) хлорид натрия
Хлорид натрия ($NaCl$) — это хорошо растворимая в воде соль. Рассмотрим различные способы её получения.
Прямой синтез из простых веществ — взаимодействие металлического натрия и газообразного хлора:
$2Na + Cl_2 \rightarrow 2NaCl$
Реакция нейтрализации — взаимодействие щёлочи (гидроксида натрия) и кислоты (соляной кислоты):
$NaOH + HCl \rightarrow NaCl + H_2O$
Взаимодействие основного оксида с кислотой:
$Na_2O + 2HCl \rightarrow 2NaCl + H_2O$
Взаимодействие активного металла с кислотой:
$2Na + 2HCl \rightarrow 2NaCl + H_2 \uparrow$
Реакция обмена между солью и кислотой, если в результате образуется газ. Например, соляная кислота вытесняет слабую и неустойчивую угольную кислоту из карбоната натрия:
$Na_2CO_3 + 2HCl \rightarrow 2NaCl + H_2O + CO_2 \uparrow$
Реакция обмена между двумя солями, если один из продуктов реакции выпадает в осадок:
$Na_2SO_4 + BaCl_2 \rightarrow 2NaCl + BaSO_4 \downarrow$
Реакция обмена между солью и основанием, если образуется газ или осадок. Взаимодействие соли аммония со щёлочью приводит к выделению газообразного аммиака:
$NH_4Cl + NaOH \rightarrow NaCl + NH_3 \uparrow + H_2O$
Вытеснение менее активного галогена из его соли более активным. Хлор как более активный галоген вытесняет бром из бромида натрия:
$2NaBr + Cl_2 \rightarrow 2NaCl + Br_2$
Ответ:
$2Na + Cl_2 \rightarrow 2NaCl$
$NaOH + HCl \rightarrow NaCl + H_2O$
$Na_2O + 2HCl \rightarrow 2NaCl + H_2O$
$2Na + 2HCl \rightarrow 2NaCl + H_2 \uparrow$
$Na_2CO_3 + 2HCl \rightarrow 2NaCl + H_2O + CO_2 \uparrow$
$Na_2SO_4 + BaCl_2 \rightarrow 2NaCl + BaSO_4 \downarrow$
$NH_4Cl + NaOH \rightarrow NaCl + NH_3 \uparrow + H_2O$
$2NaBr + Cl_2 \rightarrow 2NaCl + Br_2$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 5-121 расположенного на странице 65 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5-121 (с. 65), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.
















