Номер 5-123, страница 65 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2025
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 5. Основные классы неорганических соединений. 5.5. Соли - номер 5-123, страница 65.
№5-123 (с. 65)
Условие. №5-123 (с. 65)
скриншот условия


5-123. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения веществ:
а) Калий $ \rightarrow $ Гидроксид калия $ \rightarrow $ Карбонат калия $ \rightarrow $ Нитрат калия $ \rightarrow $ Сульфат калия;
б) Цинк $ \rightarrow $ Хлорид цинка $ \rightarrow $ Гидроксид цинка $ \rightarrow $ Оксид цинка $ \rightarrow $ Нитрат цинка;
в) Медь $ \rightarrow $ Оксид меди(II) $ \rightarrow $ Сульфат меди(II) $ \rightarrow $ Гидроксид меди(II) $ \rightarrow $ Оксид меди(II) $ \rightarrow $ Хлорид меди(II);
г) Углерод $ \rightarrow $ Углекислый газ $ \rightarrow $ Карбонат натрия $ \rightarrow $ Карбонат кальция $ \rightarrow $ Углекислый газ;
д) Водород $ \rightarrow $ Вода $ \rightarrow $ Гидроксид натрия $ \rightarrow $ Карбонат натрия $ \rightarrow $ Нитрат натрия;
е) Сера $ \rightarrow $ Сероводород $ \rightarrow $ Сульфид натрия $ \rightarrow $ Сульфид железа(II) $ \rightarrow $ Сероводород.
Решение. №5-123 (с. 65)
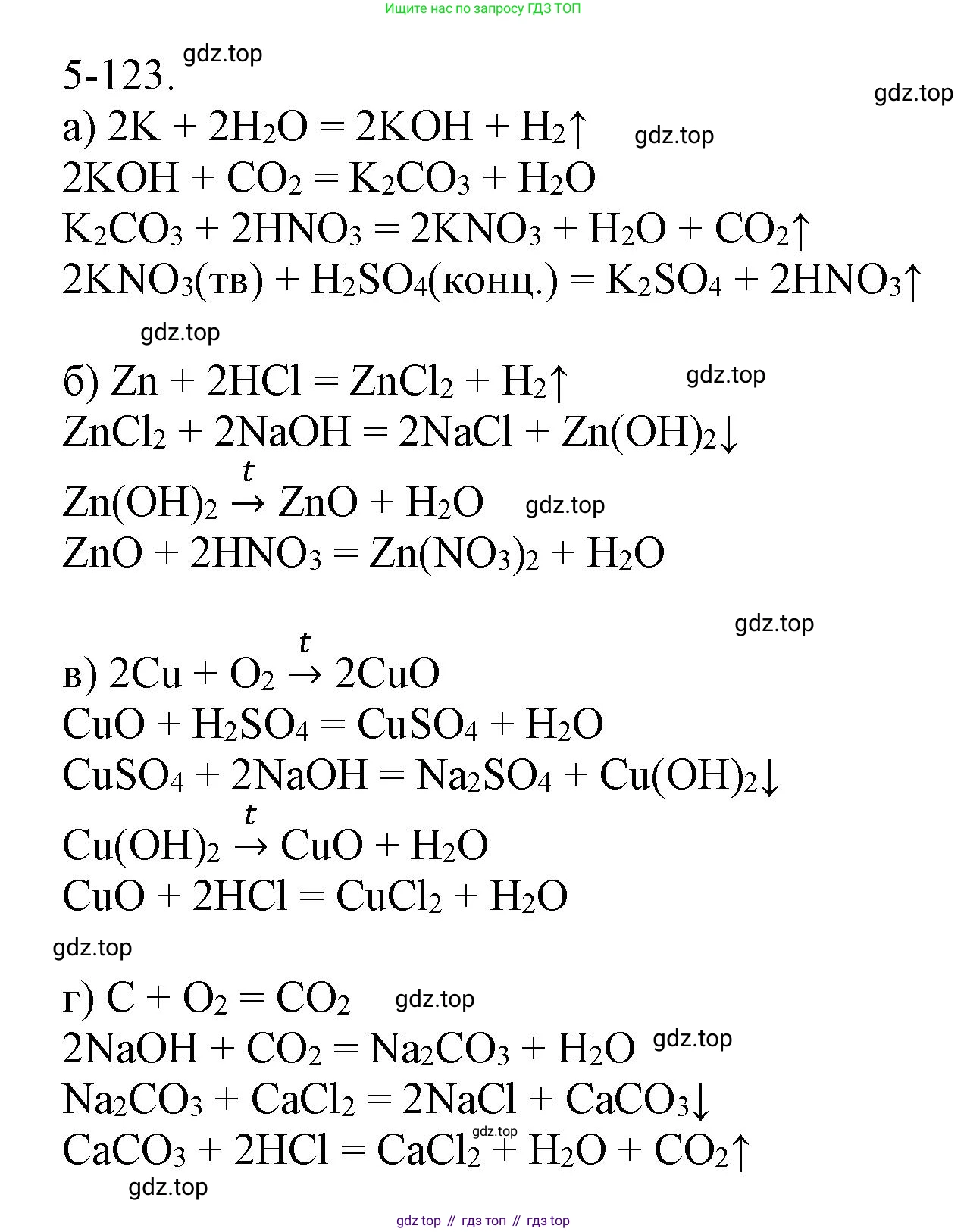
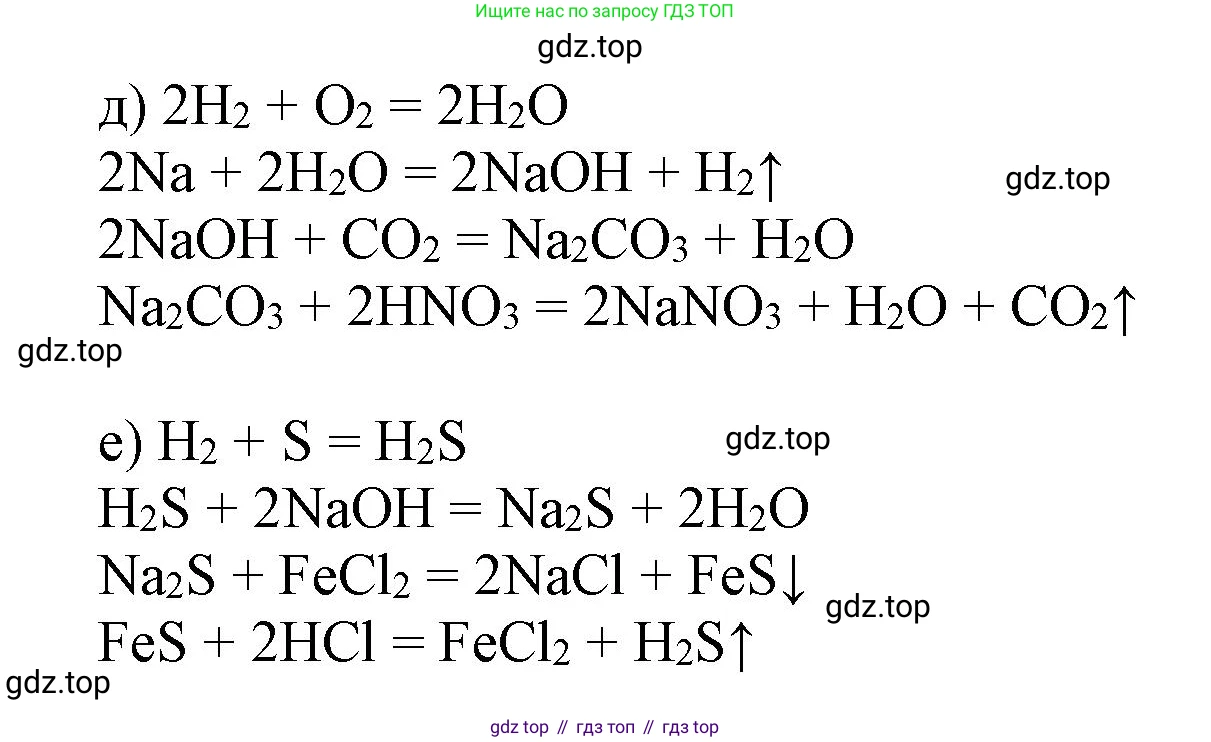
Решение 2. №5-123 (с. 65)
а) Калий → Гидроксид калия → Карбонат калия → Нитрат калия → Сульфат калия
Решение:
1. Для получения гидроксида калия из калия необходимо провести реакцию калия с водой. Калий является активным щелочным металлом и бурно реагирует с водой, образуя щелочь (гидроксид калия) и выделяя водород.
$2K + 2H_2O \rightarrow 2KOH + H_2\uparrow$
2. Чтобы получить карбонат калия из гидроксида калия, нужно провести реакцию щелочи с кислотным оксидом, в данном случае с углекислым газом ($CO_2$).
$2KOH + CO_2 \rightarrow K_2CO_3 + H_2O$
3. Для превращения карбоната калия в нитрат калия можно использовать реакцию обмена с азотной кислотой ($HNO_3$). Так как угольная кислота слабее азотной, она вытесняется из соли, разлагаясь на воду и углекислый газ.
$K_2CO_3 + 2HNO_3 \rightarrow 2KNO_3 + H_2O + CO_2\uparrow$
4. Получение сульфата калия из нитрата калия возможно при реакции с концентрированной серной кислотой при нагревании. Серная кислота, как менее летучая, вытесняет более летучую азотную кислоту из её соли.
$2KNO_3 + H_2SO_4(конц.) \xrightarrow{t} K_2SO_4 + 2HNO_3\uparrow$
Ответ:
$2K + 2H_2O \rightarrow 2KOH + H_2\uparrow$
$2KOH + CO_2 \rightarrow K_2CO_3 + H_2O$
$K_2CO_3 + 2HNO_3 \rightarrow 2KNO_3 + H_2O + CO_2\uparrow$
$2KNO_3 + H_2SO_4(конц.) \xrightarrow{t} K_2SO_4 + 2HNO_3\uparrow$
б) Цинк → Хлорид цинка → Гидроксид цинка → Оксид цинка → Нитрат цинка
Решение:
1. Хлорид цинка можно получить, проведя реакцию металлического цинка с соляной кислотой. Цинк стоит в ряду активности металлов до водорода, поэтому он вытесняет водород из кислоты.
$Zn + 2HCl \rightarrow ZnCl_2 + H_2\uparrow$
2. Для получения гидроксида цинка из его хлорида необходимо провести реакцию обмена с щелочью (например, с гидроксидом натрия). Гидроксид цинка является нерастворимым основанием и выпадает в осадок.
$ZnCl_2 + 2NaOH \rightarrow Zn(OH)_2\downarrow + 2NaCl$
3. Оксид цинка получают термическим разложением гидроксида цинка. При нагревании нерастворимые гидроксиды металлов разлагаются на соответствующий оксид и воду.
$Zn(OH)_2 \xrightarrow{t} ZnO + H_2O$
4. Оксид цинка, являясь амфотерным (в данном случае проявляя основные свойства), реагирует с кислотами. Для получения нитрата цинка нужно провести реакцию с азотной кислотой.
$ZnO + 2HNO_3 \rightarrow Zn(NO_3)_2 + H_2O$
Ответ:
$Zn + 2HCl \rightarrow ZnCl_2 + H_2\uparrow$
$ZnCl_2 + 2NaOH \rightarrow Zn(OH)_2\downarrow + 2NaCl$
$Zn(OH)_2 \xrightarrow{t} ZnO + H_2O$
$ZnO + 2HNO_3 \rightarrow Zn(NO_3)_2 + H_2O$
в) Медь → Оксид меди(II) → Сульфат меди(II) → Гидроксид меди(II) → Оксид меди(II) → Хлорид меди(II)
Решение:
1. Оксид меди(II) получают путём окисления меди кислородом при нагревании.
$2Cu + O_2 \xrightarrow{t} 2CuO$
2. Оксид меди(II) является основным оксидом и реагирует с кислотами. Для получения сульфата меди(II) его нужно смешать с серной кислотой.
$CuO + H_2SO_4 \rightarrow CuSO_4 + H_2O$
3. Гидроксид меди(II) — нерастворимое основание. Его получают реакцией обмена между растворимой солью меди(II) (сульфатом меди(II)) и щелочью.
$CuSO_4 + 2NaOH \rightarrow Cu(OH)_2\downarrow + Na_2SO_4$
4. Гидроксид меди(II) при нагревании разлагается на оксид меди(II) и воду.
$Cu(OH)_2 \xrightarrow{t} CuO + H_2O$
5. Для получения хлорида меди(II) из оксида меди(II) снова используем реакцию основного оксида с кислотой, на этот раз с соляной.
$CuO + 2HCl \rightarrow CuCl_2 + H_2O$
Ответ:
$2Cu + O_2 \xrightarrow{t} 2CuO$
$CuO + H_2SO_4 \rightarrow CuSO_4 + H_2O$
$CuSO_4 + 2NaOH \rightarrow Cu(OH)_2\downarrow + Na_2SO_4$
$Cu(OH)_2 \xrightarrow{t} CuO + H_2O$
$CuO + 2HCl \rightarrow CuCl_2 + H_2O$
г) Углерод → Углекислый газ → Карбонат натрия → Карбонат кальция → Углекислый газ
Решение:
1. Углекислый газ ($CO_2$) образуется при сжигании углерода в избытке кислорода.
$C + O_2 \xrightarrow{t} CO_2$
2. Углекислый газ — кислотный оксид, который реагирует со щелочами. Для получения карбоната натрия его пропускают через раствор гидроксида натрия.
$CO_2 + 2NaOH \rightarrow Na_2CO_3 + H_2O$
3. Карбонат кальция — нерастворимая соль. Её можно получить по реакции обмена, смешав раствор карбоната натрия с раствором соли кальция, например, хлорида кальция.
$Na_2CO_3 + CaCl_2 \rightarrow CaCO_3\downarrow + 2NaCl$
4. Углекислый газ можно снова получить из карбоната кальция либо его разложением при сильном нагревании (прокаливание известняка), либо действием сильной кислоты.
$CaCO_3 \xrightarrow{t} CaO + CO_2\uparrow$
Ответ:
$C + O_2 \xrightarrow{t} CO_2$
$CO_2 + 2NaOH \rightarrow Na_2CO_3 + H_2O$
$Na_2CO_3 + CaCl_2 \rightarrow CaCO_3\downarrow + 2NaCl$
$CaCO_3 \xrightarrow{t} CaO + CO_2\uparrow$
д) Водород → Вода → Гидроксид натрия → Карбонат натрия → Нитрат натрия
Решение:
1. Вода образуется в результате реакции горения (окисления) водорода в кислороде.
$2H_2 + O_2 \xrightarrow{t} 2H_2O$
2. Гидроксид натрия (щелочь) можно получить реакцией активного металла натрия с водой.
$2Na + 2H_2O \rightarrow 2NaOH + H_2\uparrow$
3. Карбонат натрия образуется при реакции гидроксида натрия с углекислым газом.
$2NaOH + CO_2 \rightarrow Na_2CO_3 + H_2O$
4. Нитрат натрия получают, действуя на карбонат натрия азотной кислотой.
$Na_2CO_3 + 2HNO_3 \rightarrow 2NaNO_3 + H_2O + CO_2\uparrow$
Ответ:
$2H_2 + O_2 \xrightarrow{t} 2H_2O$
$2Na + 2H_2O \rightarrow 2NaOH + H_2\uparrow$
$2NaOH + CO_2 \rightarrow Na_2CO_3 + H_2O$
$Na_2CO_3 + 2HNO_3 \rightarrow 2NaNO_3 + H_2O + CO_2\uparrow$
е) Сера → Сероводород → Сульфид натрия → Сульфид железа(II) → Сероводород
Решение:
1. Сероводород ($H_2S$) получают прямым синтезом из простых веществ — серы и водорода — при нагревании.
$H_2 + S \xrightarrow{t} H_2S$
2. Сероводород проявляет свойства слабой кислоты и реагирует со щелочами, образуя соль (сульфид) и воду.
$H_2S + 2NaOH \rightarrow Na_2S + 2H_2O$
3. Сульфид железа(II) — нерастворимое соединение. Его можно получить реакцией обмена между раствором сульфида натрия и раствором соли железа(II), например, сульфата железа(II).
$Na_2S + FeSO_4 \rightarrow FeS\downarrow + Na_2SO_4$
4. Сероводород можно снова получить, подействовав на сульфид железа(II) сильной кислотой (например, соляной).
$FeS + 2HCl \rightarrow FeCl_2 + H_2S\uparrow$
Ответ:
$H_2 + S \xrightarrow{t} H_2S$
$H_2S + 2NaOH \rightarrow Na_2S + 2H_2O$
$Na_2S + FeSO_4 \rightarrow FeS\downarrow + Na_2SO_4$
$FeS + 2HCl \rightarrow FeCl_2 + H_2S\uparrow$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 5-123 расположенного на странице 65 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5-123 (с. 65), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.
















