Вариант 3, страница 71 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2025
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 5. Основные классы неорганических соединений. Контрольная работа по теме «Основные классы неорганических соединений» - страница 71.
Вариант 3 (с. 71)
Условие. Вариант 3 (с. 71)
скриншот условия

Вариант 3
1. Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы(IV), гидроксид натрия, азотная кислота.
2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ:
Медь $ \to $ Хлорид меди(II) $ \to $ Гидроксид меди(II) $ \to $ Оксид меди(II) $ \to $ Сульфат меди(II) $ \to $ Медь.
3. Напишите уравнения реакций, в результате которых образуется а) карбонат кальция, б) соляная кислота. Найдите возможно большее число различных способов.
4. В трех склянках без этикеток находятся растворы карбоната натрия, нитрата натрия и сульфата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций; ход распознавания представьте в виде таблицы.
5. Вычислите объем водорода (н.у.), образующегося при взаимодействии 48 г магния с избытком серной кислоты.
Решение. Вариант 3 (с. 71)

Решение 2. Вариант 3 (с. 71)
1. Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы(IV), гидроксид натрия, азотная кислота.
Представленные вещества и их классы:
- Оксид бария ($BaO$) - основный оксид
- Оксид серы(IV) ($SO_2$) - кислотный оксид
- Гидроксид натрия ($NaOH$) - щёлочь (основание)
- Азотная кислота ($HNO_3$) - кислота
Возможные реакции между ними (в основном кислотно-основные взаимодействия):
1. Основный оксид с кислотным оксидом:
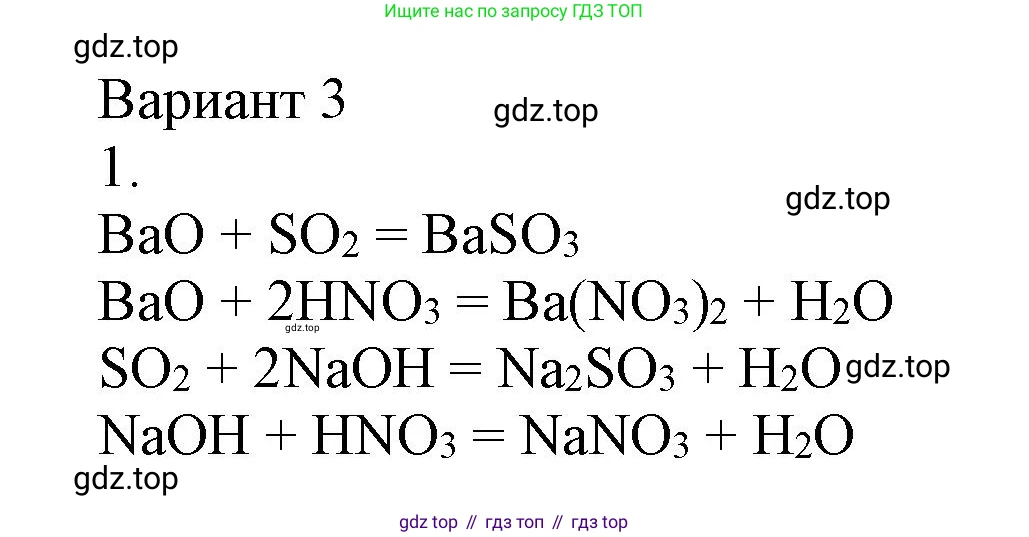
$BaO + SO_2 \rightarrow BaSO_3$
2. Основный оксид с кислотой:
$BaO + 2HNO_3 \rightarrow Ba(NO_3)_2 + H_2O$
3. Кислотный оксид со щёлочью. Возможны две реакции в зависимости от соотношения реагентов:
$SO_2 + 2NaOH \rightarrow Na_2SO_3 + H_2O$ (при избытке щёлочи)
$SO_2 + NaOH \rightarrow NaHSO_3$ (при избытке кислотного оксида)
4. Кислота со щёлочью (реакция нейтрализации):
$HNO_3 + NaOH \rightarrow NaNO_3 + H_2O$
Реакции между веществами одного класса (основный оксид и щёлочь, кислотный оксид и кислота) в данных условиях не протекают.
Ответ:
$BaO + SO_2 \rightarrow BaSO_3$
$BaO + 2HNO_3 \rightarrow Ba(NO_3)_2 + H_2O$
$SO_2 + 2NaOH \rightarrow Na_2SO_3 + H_2O$
$SO_2 + NaOH \rightarrow NaHSO_3$
$HNO_3 + NaOH \rightarrow NaNO_3 + H_2O$
2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Медь → Хлорид меди(II) → Гидроксид меди(II) → Оксид меди(II) → Сульфат меди(II) → Медь.
1. $Cu \rightarrow CuCl_2$ (взаимодействие с хлором при нагревании):
$Cu + Cl_2 \xrightarrow{t} CuCl_2$
2. $CuCl_2 \rightarrow Cu(OH)_2$ (реакция обмена с щёлочью, например, с гидроксидом натрия):
$CuCl_2 + 2NaOH \rightarrow Cu(OH)_2\downarrow + 2NaCl$
3. $Cu(OH)_2 \rightarrow CuO$ (термическое разложение нерастворимого гидроксида меди(II)):
$Cu(OH)_2 \xrightarrow{t} CuO + H_2O$
4. $CuO \rightarrow CuSO_4$ (взаимодействие основного оксида с серной кислотой):
$CuO + H_2SO_4 \rightarrow CuSO_4 + H_2O$
5. $CuSO_4 \rightarrow Cu$ (вытеснение меди из раствора её соли более активным металлом, например, цинком):
$CuSO_4 + Zn \rightarrow ZnSO_4 + Cu\downarrow$
Ответ:
1. $Cu + Cl_2 \xrightarrow{t} CuCl_2$
2. $CuCl_2 + 2NaOH \rightarrow Cu(OH)_2\downarrow + 2NaCl$
3. $Cu(OH)_2 \xrightarrow{t} CuO + H_2O$
4. $CuO + H_2SO_4 \rightarrow CuSO_4 + H_2O$
5. $CuSO_4 + Zn \rightarrow ZnSO_4 + Cu$
3. Напишите уравнения реакций, в результате которых образуется а) карбонат кальция, б) соляная кислота. Найдите возможно большее число различных способов.
а) Способы получения карбоната кальция ($CaCO_3$):
1. Взаимодействие основного оксида (оксида кальция) с кислотным оксидом (оксидом углерода(IV)):
$CaO + CO_2 \xrightarrow{t} CaCO_3$
2. Пропускание углекислого газа через раствор гидроксида кальция (известковую воду):
$Ca(OH)_2 + CO_2 \rightarrow CaCO_3\downarrow + H_2O$
3. Реакция ионного обмена между растворимой солью кальция и растворимым карбонатом:
$CaCl_2 + Na_2CO_3 \rightarrow CaCO_3\downarrow + 2NaCl$
4. Реакция ионного обмена между гидроксидом кальция и растворимым карбонатом:
$Ca(OH)_2 + K_2CO_3 \rightarrow CaCO_3\downarrow + 2KOH$
5. Термическое разложение гидрокарбоната кальция:
$Ca(HCO_3)_2 \xrightarrow{t} CaCO_3\downarrow + H_2O + CO_2\uparrow$
Ответ:
$CaO + CO_2 \rightarrow CaCO_3$
$Ca(OH)_2 + CO_2 \rightarrow CaCO_3\downarrow + H_2O$
$CaCl_2 + Na_2CO_3 \rightarrow CaCO_3\downarrow + 2NaCl$
$Ca(OH)_2 + K_2CO_3 \rightarrow CaCO_3\downarrow + 2KOH$
$Ca(HCO_3)_2 \xrightarrow{t} CaCO_3\downarrow + H_2O + CO_2\uparrow$
б) Способы получения соляной кислоты ($HCl$):
1. Прямой синтез из простых веществ (водорода и хлора) на свету или при нагревании:
$H_2 + Cl_2 \xrightarrow{h\nu} 2HCl$
2. Вытеснение летучей соляной кислоты из её солей менее летучей кислотой (сульфатный метод):
$2NaCl (тв.) + H_2SO_4 (конц.) \xrightarrow{t} Na_2SO_4 + 2HCl\uparrow$
3. Гидролиз некоторых ковалентных хлоридов, например, хлорида фосфора(V):
$PCl_5 + 4H_2O \rightarrow H_3PO_4 + 5HCl$
4. Реакция ионного обмена, в результате которой образуется нерастворимый осадок:
$BaCl_2 + H_2SO_4 \rightarrow BaSO_4\downarrow + 2HCl$
Ответ:
$H_2 + Cl_2 \xrightarrow{h\nu} 2HCl$
$2NaCl (тв.) + H_2SO_4 (конц.) \rightarrow Na_2SO_4 + 2HCl\uparrow$
$PCl_5 + 4H_2O \rightarrow H_3PO_4 + 5HCl$
$BaCl_2 + H_2SO_4 \rightarrow BaSO_4\downarrow + 2HCl$
4. В трех склянках без этикеток находятся растворы карбоната натрия, нитрата натрия и сульфата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций; ход распознавания представьте в виде таблицы.
Для распознавания растворов карбоната натрия ($Na_2CO_3$), нитрата натрия ($NaNO_3$) и сульфата натрия ($Na_2SO_4$) необходимо провести качественные реакции на анионы $CO_3^{2-}$ и $SO_4^{2-}$. План распознавания и результаты можно представить в виде таблицы.
| Действие | Пробирка 1 (предположим, $Na_2CO_3$) | Пробирка 2 (предположим, $Na_2SO_4$) | Пробирка 3 (предположим, $NaNO_3$) |
|---|---|---|---|
| 1. Добавляем в каждую пробирку по несколько капель раствора сильной кислоты, например, соляной ($HCl$). | Наблюдается бурное выделение бесцветного газа без запаха (шипение). | Видимых изменений нет. | Видимых изменений нет. |
| 2. В пробирки, где не было реакции (2 и 3), добавляем раствор хлорида бария ($BaCl_2$). | (вещество определено на первом этапе) | Выпадает белый мелкокристаллический осадок, нерастворимый в кислотах. | Видимых изменений нет. |
| Вывод | В пробирке 1 находится карбонат натрия. | В пробирке 2 находится сульфат натрия. | В пробирке 3 находится нитрат натрия. |
Уравнения протекающих реакций:
1. Реакция с кислотой для обнаружения карбонат-иона:
$Na_2CO_3 + 2HCl \rightarrow 2NaCl + H_2O + CO_2\uparrow$
2. Реакция с солью бария для обнаружения сульфат-иона:
$Na_2SO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + 2NaCl$
Ответ: Для распознавания веществ необходимо сначала к пробам из каждой склянки добавить раствор сильной кислоты (например, $HCl$). В склянке с карбонатом натрия будет наблюдаться выделение газа ($CO_2$). К оставшимся двум пробам, где реакции не было, следует добавить раствор соли бария (например, $BaCl_2$). В склянке с сульфатом натрия выпадет белый осадок ($BaSO_4$). Склянка, в которой не произошло видимых изменений ни на первом, ни на втором этапе, содержит нитрат натрия. Уравнения реакций: $Na_2CO_3 + 2HCl \rightarrow 2NaCl + H_2O + CO_2\uparrow$; $Na_2SO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + 2NaCl$.
5. Вычислите объем водорода (н.у.), образующегося при взаимодействии 48 г магния с избытком серной кислоты.
Дано:
Масса магния $m(Mg) = 48 \text{ г}$
Серная кислота ($H_2SO_4$) - в избытке
Условия - нормальные (н.у.)
$m(Mg) = 48 \text{ г} = 0.048 \text{ кг}$
Молярная масса магния $M(Mg) \approx 24 \text{ г/моль} = 0.024 \text{ кг/моль}$
Молярный объем газа при н.у. $V_m = 22.4 \text{ л/моль} = 0.0224 \text{ м³/моль}$
Найти:
Объем водорода $V(H_2)$ - ?
Решение:
1. Запишем уравнение химической реакции магния с серной кислотой:
$Mg + H_2SO_4 \rightarrow MgSO_4 + H_2\uparrow$
2. Найдем количество вещества магния ($Mg$), вступившего в реакцию. Молярная масса магния $M(Mg) \approx 24 \text{ г/моль}$.
$n(Mg) = \frac{m(Mg)}{M(Mg)} = \frac{48 \text{ г}}{24 \text{ г/моль}} = 2 \text{ моль}$
3. По уравнению реакции определим количество вещества водорода ($H_2$). Из уравнения видно, что стехиометрическое соотношение $Mg$ и $H_2$ составляет 1:1.
$\frac{n(Mg)}{1} = \frac{n(H_2)}{1}$
$n(H_2) = n(Mg) = 2 \text{ моль}$
4. Рассчитаем объем водорода, который образуется при нормальных условиях (н.у.). Молярный объем идеального газа при н.у. равен $V_m = 22.4 \text{ л/моль}$.
$V(H_2) = n(H_2) \cdot V_m = 2 \text{ моль} \cdot 22.4 \text{ л/моль} = 44.8 \text{ л}$
Ответ: объем водорода, образующегося при реакции, составляет $44.8$ л.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения Вариант 3 расположенного на странице 71 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Вариант 3 (с. 71), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.
















