Номер 6-2, страница 73 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2025
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 6. Строение атома. Периодический закон и периодическая система Д. И. Менделеева в свете электронной теории. 6.1. Атомное ядро. Изотопы - номер 6-2, страница 73.
№6-2 (с. 73)
Условие. №6-2 (с. 73)
скриншот условия

6-2. Рассчитайте относительную атомную массу меди, если известно, что доля изотопа $^\text{63}\text{Cu}$ составляет приблизительно 69% от общего количества атомов меди, а доля изотопов $^\text{65}\text{Cu}$ – 31%.
Решение. №6-2 (с. 73)
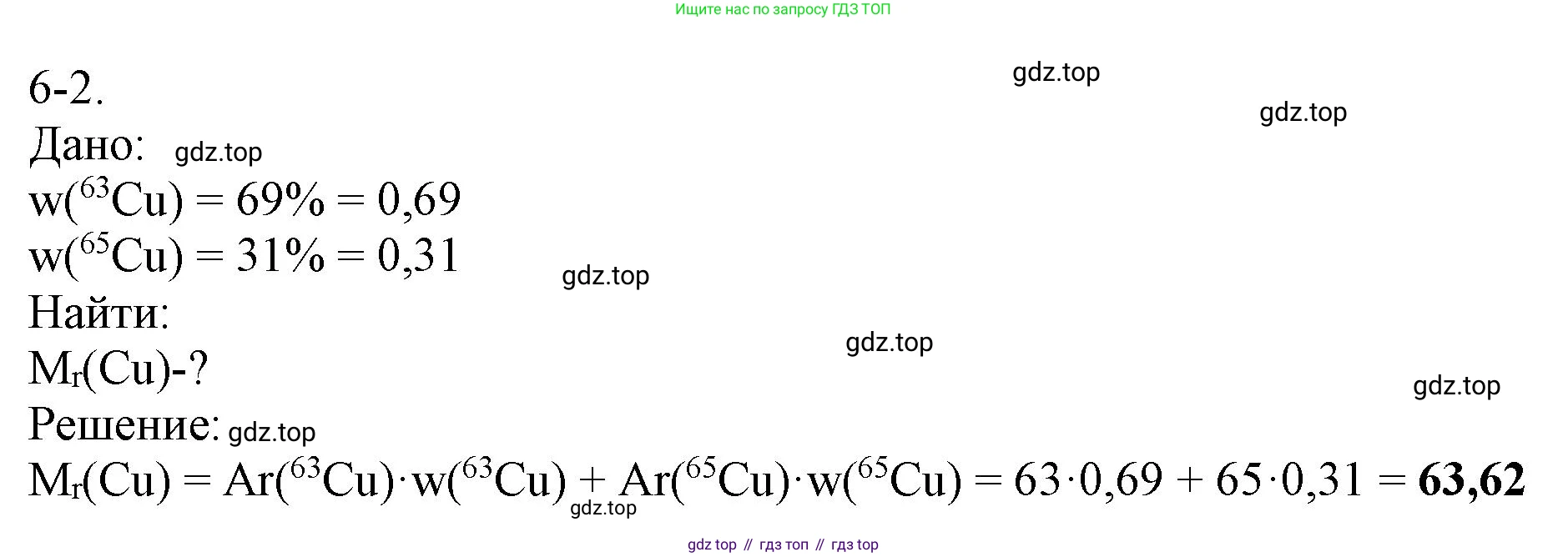
Решение 2. №6-2 (с. 73)
6-2.
Дано:
Доля изотопа $^{63}\text{Cu}$, $w(^{63}\text{Cu}) = 69\%$
Доля изотопа $^{65}\text{Cu}$, $w(^{65}\text{Cu}) = 31\%$
Атомная масса изотопа $^{63}\text{Cu}$, $A_r(^{63}\text{Cu}) \approx 63$ а.е.м.
Атомная масса изотопа $^{65}\text{Cu}$, $A_r(^{65}\text{Cu}) \approx 65$ а.е.м.
Найти:
Относительную атомную массу меди, $A_r(\text{Cu})$
Решение:
Относительная атомная масса химического элемента является средневзвешенной величиной атомных масс его природных изотопов с учетом их процентного содержания (распространенности).
Для расчета относительной атомной массы ($A_r$) используется формула:
$A_r(\text{Э}) = A_r(\text{изотоп 1}) \cdot w(\text{изотоп 1}) + A_r(\text{изотоп 2}) \cdot w(\text{изотоп 2}) + \dots$
где $A_r(\text{изотоп})$ — относительная атомная масса изотопа (которую для упрощения можно принять равной его массовому числу), а $w$ — его доля (распространенность) в природной смеси, выраженная в долях от единицы.
Сначала переведем процентное содержание изотопов в доли от единицы:
$w(^{63}\text{Cu}) = 69\% / 100\% = 0.69$
$w(^{65}\text{Cu}) = 31\% / 100\% = 0.31$
Теперь подставим данные значения в формулу для расчета относительной атомной массы меди:
$A_r(\text{Cu}) = A_r(^{63}\text{Cu}) \cdot w(^{63}\text{Cu}) + A_r(^{65}\text{Cu}) \cdot w(^{65}\text{Cu})$
$A_r(\text{Cu}) = 63 \cdot 0.69 + 65 \cdot 0.31$
Выполним вычисления:
$A_r(\text{Cu}) = 43.47 + 20.15$
$A_r(\text{Cu}) = 63.62$
Ответ: относительная атомная масса меди составляет 63.62.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 6-2 расположенного на странице 73 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6-2 (с. 73), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.















