Номер 14, страница 40 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
5. Теория электролитической диссоциации. Реакции ионного обмена. Упражнения и задачи для самостоятельного решения - номер 14, страница 40.
№14 (с. 40)
Условие. №14 (с. 40)
скриншот условия

14. Приведите по два примера реакций, соответствующих представленным ионным уравнениям:
a) $ \text{H}^{+} + \text{OH}^{-} = \text{H}_2\text{O} $
б) $ 3\text{Ca}^{2+} + 2\text{PO}_4^{3-} = \text{Ca}_3(\text{PO}_4)_2 $
в) $ \text{Ba}^{2+} + \text{SO}_4^{2-} = \text{BaSO}_4 $
г) $ \text{CO}_3^{2-} + 2\text{H}^{+} = \text{CO}_2 + \text{H}_2\text{O} $
д) $ \text{Fe}(\text{OH})_3 + 6\text{H}^{+} = \text{Fe}^{3+} + 6\text{H}_2\text{O} $
е) $ \text{Al}^{3+} + 3\text{OH}^{-} = \text{Al}(\text{OH})_3 $
Решение. №14 (с. 40)
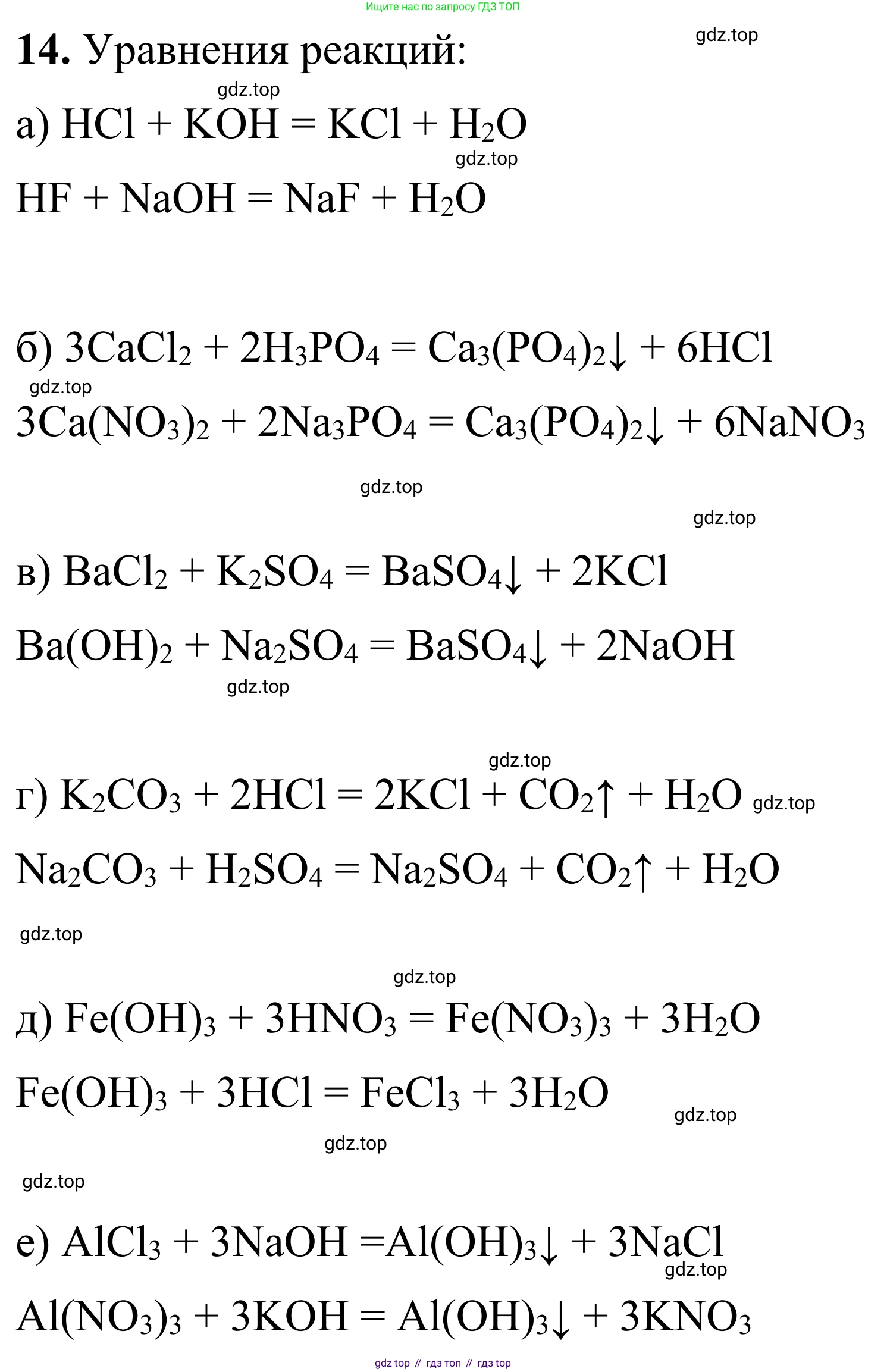
Решение 2. №14 (с. 40)
а) Данное сокращенное ионное уравнение $H^+ + OH^- = H_2O$ описывает реакцию нейтрализации, которая протекает между сильной кислотой и сильным основанием, в результате чего образуется вода. Для соответствия этому уравнению оба реагента (кислота и основание) и образующаяся соль должны быть хорошо растворимы и диссоциированы в воде.
Примеры реакций:
1. Взаимодействие соляной кислоты и гидроксида натрия: $HCl + NaOH = NaCl + H_2O$.
2. Взаимодействие азотной кислоты и гидроксида калия: $HNO_3 + KOH = KNO_3 + H_2O$.
Ответ: $HCl + NaOH = NaCl + H_2O$ и $HNO_3 + KOH = KNO_3 + H_2O$.
б) Сокращенное ионное уравнение $3Ca^{2+} + 2PO_4^{3-} = Ca_3(PO_4)_2$ описывает реакцию ионного обмена, приводящую к образованию нерастворимого осадка фосфата кальция. Для этого необходимо смешать растворы растворимой соли кальция и растворимого фосфата.
Примеры реакций:
1. Взаимодействие хлорида кальция и фосфата натрия: $3CaCl_2 + 2Na_3PO_4 = Ca_3(PO_4)_2 \downarrow + 6NaCl$.
2. Взаимодействие нитрата кальция и фосфата калия: $3Ca(NO_3)_2 + 2K_3PO_4 = Ca_3(PO_4)_2 \downarrow + 6KNO_3$.
Ответ: $3CaCl_2 + 2Na_3PO_4 = Ca_3(PO_4)_2 \downarrow + 6NaCl$ и $3Ca(NO_3)_2 + 2K_3PO_4 = Ca_3(PO_4)_2 \downarrow + 6KNO_3$.
в) Ионное уравнение $Ba^{2+} + SO_4^{2-} = BaSO_4$ соответствует реакции образования нерастворимого осадка сульфата бария. Такая реакция происходит при смешивании растворов, содержащих ионы бария $Ba^{2+}$ (из растворимой соли бария) и сульфат-ионы $SO_4^{2-}$ (из серной кислоты или ее растворимых солей).
Примеры реакций:
1. Взаимодействие хлорида бария и серной кислоты: $BaCl_2 + H_2SO_4 = BaSO_4 \downarrow + 2HCl$.
2. Взаимодействие нитрата бария и сульфата натрия: $Ba(NO_3)_2 + Na_2SO_4 = BaSO_4 \downarrow + 2NaNO_3$.
Ответ: $BaCl_2 + H_2SO_4 = BaSO_4 \downarrow + 2HCl$ и $Ba(NO_3)_2 + Na_2SO_4 = BaSO_4 \downarrow + 2NaNO_3$.
г) Уравнение $CO_3^{2-} + 2H^+ = CO_2 + H_2O$ описывает взаимодействие карбонатов с сильными кислотами. В результате реакции выделяется углекислый газ и образуется вода. Исходный карбонат должен быть растворимым, чтобы в растворе присутствовали карбонат-ионы $CO_3^{2-}$.
Примеры реакций:
1. Взаимодействие карбоната натрия и соляной кислоты: $Na_2CO_3 + 2HCl = 2NaCl + CO_2 \uparrow + H_2O$.
2. Взаимодействие карбоната калия и серной кислоты: $K_2CO_3 + H_2SO_4 = K_2SO_4 + CO_2 \uparrow + H_2O$.
Ответ: $Na_2CO_3 + 2HCl = 2NaCl + CO_2 \uparrow + H_2O$ и $K_2CO_3 + H_2SO_4 = K_2SO_4 \uparrow + H_2O$.
д) Ионное уравнение $Fe(OH)_3 + 3H^+ = Fe^{3+} + 3H_2O$ (предполагается исправление опечатки в условии, где было указано 6$H^+$ и 6$H_2O$) показывает реакцию растворения нерастворимого основания, гидроксида железа(III), в сильной кислоте с образованием растворимой соли железа(III) и воды.
Примеры реакций:
1. Взаимодействие гидроксида железа(III) и соляной кислоты: $Fe(OH)_3 + 3HCl = FeCl_3 + 3H_2O$.
2. Взаимодействие гидроксида железа(III) и серной кислоты: $2Fe(OH)_3 + 3H_2SO_4 = Fe_2(SO_4)_3 + 6H_2O$.
Ответ: $Fe(OH)_3 + 3HCl = FeCl_3 + 3H_2O$ и $2Fe(OH)_3 + 3H_2SO_4 = Fe_2(SO_4)_3 + 6H_2O$.
е) Уравнение $Al^{3+} + 3OH^- = Al(OH)_3$ соответствует реакции осаждения амфотерного гидроксида алюминия. Реакция происходит при добавлении щелочи к раствору соли алюминия.
Примеры реакций:
1. Взаимодействие хлорида алюминия и гидроксида натрия: $AlCl_3 + 3NaOH = Al(OH)_3 \downarrow + 3NaCl$.
2. Взаимодействие сульфата алюминия и гидроксида калия: $Al_2(SO_4)_3 + 6KOH = 2Al(OH)_3 \downarrow + 3K_2SO_4$.
Ответ: $AlCl_3 + 3NaOH = Al(OH)_3 \downarrow + 3NaCl$ и $Al_2(SO_4)_3 + 6KOH = 2Al(OH)_3 \downarrow + 3K_2SO_4$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 14 расположенного на странице 40 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №14 (с. 40), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















