Номер 51, страница 69 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2025
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
7. Кислород, сера и их соединения. Упражнения и задачи для самостоятельного решения - номер 51, страница 69.
№51 (с. 69)
Условие. №51 (с. 69)
скриншот условия

51. Составьте уравнения возможных реакций с участием серной кислоты. Реакции ионного обмена запишите в молекулярной, полной и сокращённой ионной форме.
а) $H_2SO_4(\text{разб.}) + Cu \to$
б) $H_2SO_4(\text{разб.}) + Al(OH)_3 \to$
в) $H_2SO_4(\text{разб.}) + CaO \to$
г) $H_2SO_4(\text{конц.}) + BaCl_2 \to$
д) $H_2SO_4(\text{конц.}) + MgCl_2 \to$
е) $H_2SO_4(\text{конц.}) + Au \to$
Решение. №51 (с. 69)
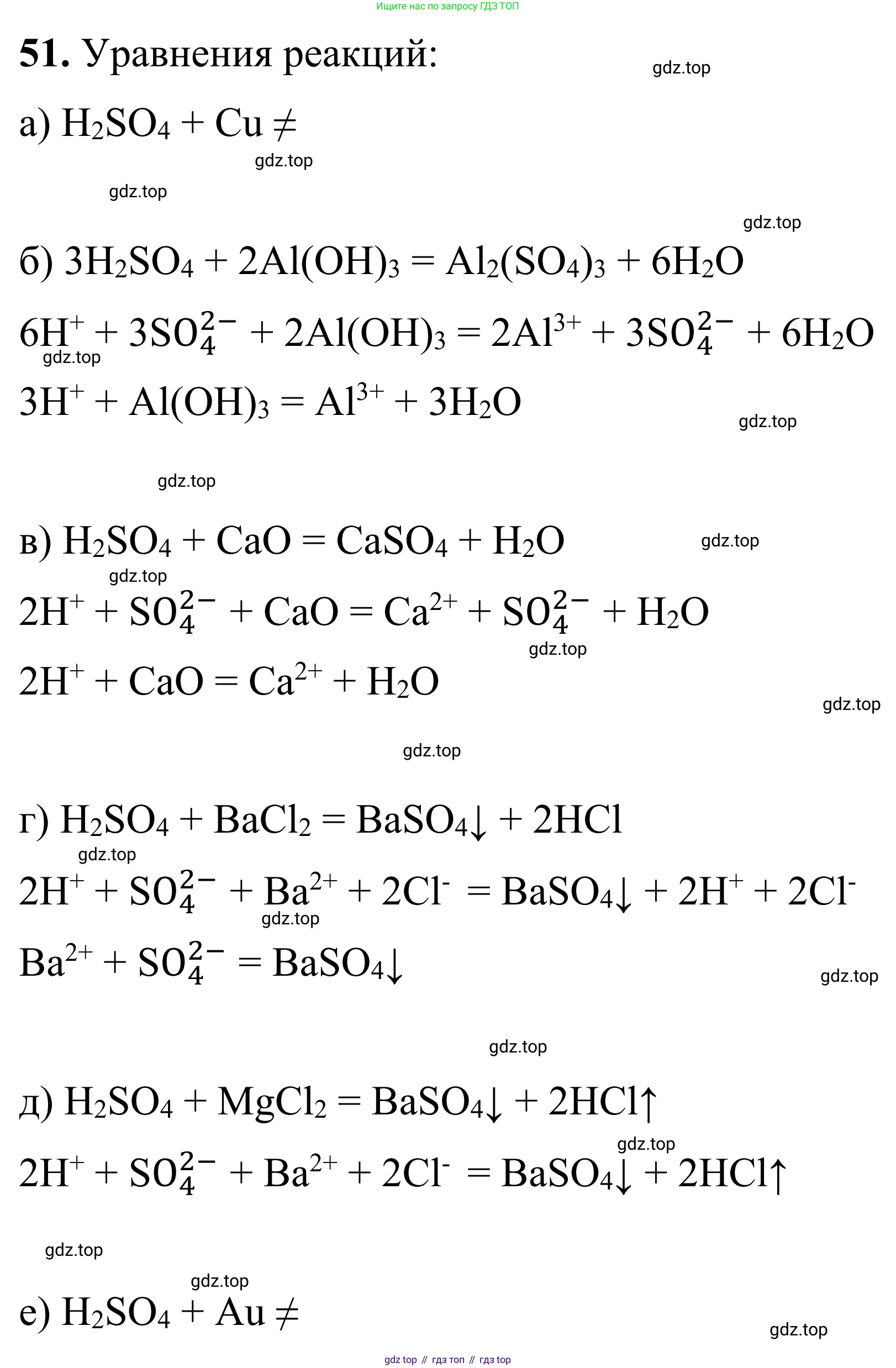
Решение 2. №51 (с. 69)
а) H2SO4(разб.) + Cu →
Реакция не протекает. Разбавленная серная кислота является кислотой-неокислителем и может реагировать только с металлами, стоящими в ряду активности до водорода. Медь (Cu) стоит после водорода, поэтому она не может вытеснить его из разбавленной кислоты.
Ответ: реакция невозможна.
б) H2SO4(разб.) + Al(OH)3 →
Это реакция ионного обмена (реакция нейтрализации) между сильной кислотой и нерастворимым основанием (амфотерным гидроксидом). В результате образуются соль сульфат алюминия и вода.
Молекулярное уравнение:
$2Al(OH)_3 + 3H_2SO_4 \rightarrow Al_2(SO_4)_3 + 6H_2O$
Полное ионное уравнение (гидроксид алюминия - нерастворимое вещество, серная кислота - сильный электролит, сульфат алюминия - растворимая соль, вода - слабый электролит):
$2Al(OH)_3 + 6H^+ + 3SO_4^{2-} \rightarrow 2Al^{3+} + 3SO_4^{2-} + 6H_2O$
Сокращенное ионное уравнение (после сокращения одинаковых ионов $SO_4^{2-}$):
$2Al(OH)_3 + 6H^+ \rightarrow 2Al^{3+} + 6H_2O$
Сократив все коэффициенты на 2, получаем:
$Al(OH)_3 + 3H^+ \rightarrow Al^{3+} + 3H_2O$
Ответ: Молекулярное уравнение: $2Al(OH)_3 + 3H_2SO_4 \rightarrow Al_2(SO_4)_3 + 6H_2O$. Сокращенное ионное уравнение: $Al(OH)_3 + 3H^+ \rightarrow Al^{3+} + 3H_2O$.
в) H2SO4(разб.) + CaO →
Это реакция ионного обмена между сильной кислотой и основным оксидом. В результате образуются соль сульфат кальция и вода. Сульфат кальция ($CaSO_4$) является малорастворимым веществом, поэтому в ионных уравнениях его принято записывать в виде осадка.
Молекулярное уравнение:
$H_2SO_4 + CaO \rightarrow CaSO_4\downarrow + H_2O$
Полное ионное уравнение (оксид кальция - твердое вещество, серная кислота - сильный электролит, сульфат кальция - осадок, вода - слабый электролит):
$2H^+ + SO_4^{2-} + CaO \rightarrow CaSO_4\downarrow + H_2O$
Сокращенное ионное уравнение (в данном случае отсутствуют ионы-наблюдатели, поэтому полное ионное уравнение является и сокращенным):
$2H^+ + SO_4^{2-} + CaO \rightarrow CaSO_4\downarrow + H_2O$
Ответ: Молекулярное уравнение: $H_2SO_4 + CaO \rightarrow CaSO_4\downarrow + H_2O$. Сокращенное ионное уравнение: $2H^+ + SO_4^{2-} + CaO \rightarrow CaSO_4\downarrow + H_2O$.
г) H2SO4(конц.) + BaCl2 →
Это реакция ионного обмена, которая протекает благодаря образованию нерастворимого в кислотах осадка сульфата бария ($BaSO_4$). Реакция идет как с разбавленной, так и с концентрированной кислотой.
Молекулярное уравнение:
$H_2SO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + 2HCl$
Полное ионное уравнение (принимая, что реакция идет в водном растворе, где все исходные вещества, кроме продукта $BaSO_4$, являются сильными электролитами):
$2H^+ + SO_4^{2-} + Ba^{2+} + 2Cl^- \rightarrow BaSO_4\downarrow + 2H^+ + 2Cl^-$
Сокращенное ионное уравнение (после сокращения ионов $H^+$ и $Cl^-$):
$Ba^{2+} + SO_4^{2-} \rightarrow BaSO_4\downarrow$
Ответ: Молекулярное уравнение: $H_2SO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + 2HCl$. Сокращенное ионное уравнение: $Ba^{2+} + SO_4^{2-} \rightarrow BaSO_4\downarrow$.
д) H2SO4(конц.) + MgCl2 →
Реакция ионного обмена в растворе не протекает, так как все возможные продукты ($MgSO_4$ и $HCl$) являются растворимыми и сильными электролитами, т.е. не образуется ни осадка, ни газа, ни слабого электролита. Однако, реакция возможна при нагревании смеси концентрированной серной кислоты и твердого хлорида магния. В этом случае летучая соляная кислота выделяется в виде газа, что смещает равновесие вправо. Данная реакция не является ионным обменом в водном растворе.
Уравнение реакции при нагревании:
$H_2SO_4(\text{конц.}) + MgCl_2(\text{тв}) \xrightarrow{\Delta} MgSO_4 + 2HCl\uparrow$
Ответ: В условиях реакции ионного обмена в растворе реакция невозможна. При нагревании твердого $MgCl_2$ с концентрированной $H_2SO_4$ реакция идет по уравнению: $H_2SO_4(\text{конц.}) + MgCl_2(\text{тв}) \xrightarrow{\Delta} MgSO_4 + 2HCl\uparrow$.
е) H2SO4(конц.) + Au →
Реакция не протекает. Золото (Au) — благородный металл, который не реагирует даже с концентрированной серной кислотой, так как обладает очень низкой химической активностью и высоким окислительно-восстановительным потенциалом.
Ответ: реакция невозможна.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 51 расположенного на странице 69 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №51 (с. 69), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















