Номер 4, страница 70 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 4. Кислород и сера. Параграф 19. Сероводород. Сульфиды. Подумай, ответь, выполни... - номер 4, страница 70.
№4 (с. 70)
Условие. №4 (с. 70)
скриншот условия

4. Сероводород пропустили через 200 г раствора сульфата меди(II) (массовая доля $CuSO_4$ равна 18%). Вычислите массу осадка, выпавшего в результате этой реакции.
Решение. №4 (с. 70)

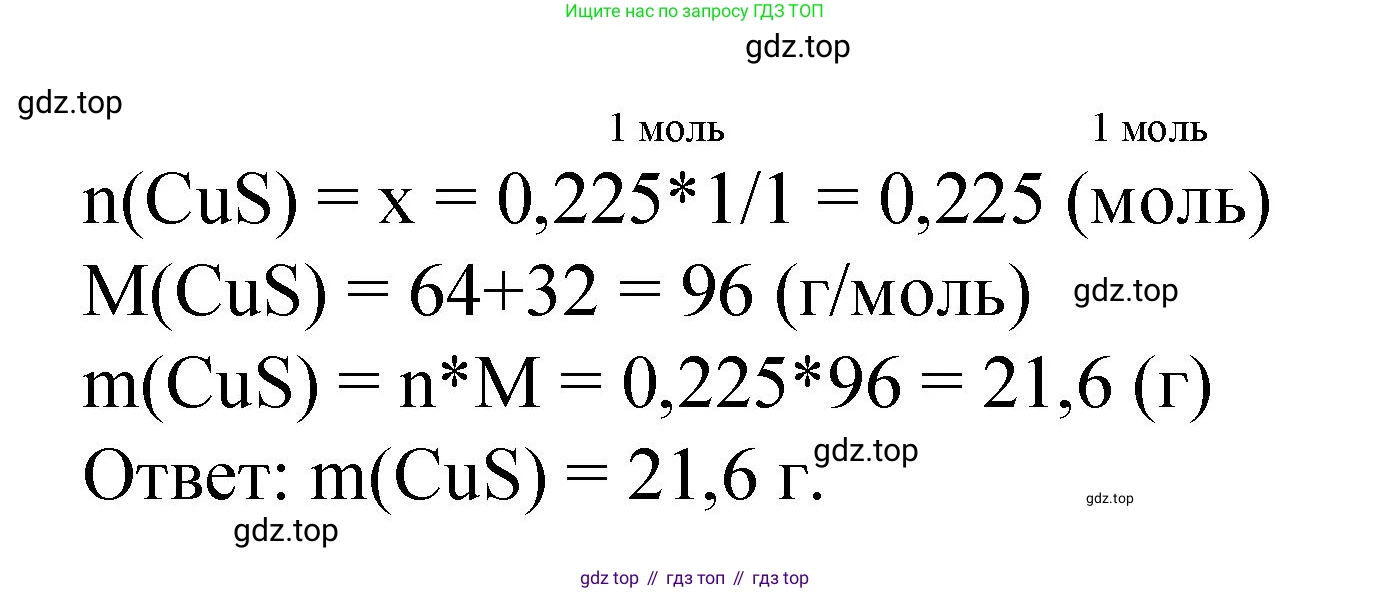
Решение 2. №4 (с. 70)
Дано:
$m_{р-ра}(CuSO_4) = 200 \text{ г}$
$\omega(CuSO_4) = 18\%$
$m_{р-ра}(CuSO_4) = 0.2 \text{ кг}$
$\omega(CuSO_4) = 0.18$ (в долях единицы)
Найти:
$m_{осадка} - ?$
Решение:
1. Составим уравнение химической реакции. При пропускании сероводорода ($H_2S$) через раствор сульфата меди(II) ($CuSO_4$) происходит реакция обмена, в результате которой образуется нерастворимый осадок — сульфид меди(II) ($CuS$) черного цвета и серная кислота ($H_2SO_4$):
$CuSO_4 + H_2S \rightarrow CuS \downarrow + H_2SO_4$
2. Рассчитаем массу чистого сульфата меди(II), содержащегося в 200 г 18%-го раствора, по формуле:
$m_{вещества} = m_{раствора} \times \omega_{вещества}$
$m(CuSO_4) = 200 \text{ г} \times 0.18 = 36 \text{ г}$
3. Вычислим молярные массы реагента ($CuSO_4$) и продукта реакции, являющегося осадком ($CuS$). Для этого используем значения относительных атомных масс из Периодической системы химических элементов Д. И. Менделеева: $Ar(Cu) = 64 \text{ а.е.м.}$, $Ar(S) = 32 \text{ а.е.м.}$, $Ar(O) = 16 \text{ а.е.м.}$
$M(CuSO_4) = Ar(Cu) + Ar(S) + 4 \times Ar(O) = 64 + 32 + 4 \times 16 = 160 \text{ г/моль}$
$M(CuS) = Ar(Cu) + Ar(S) = 64 + 32 = 96 \text{ г/моль}$
4. Найдем количество вещества (в молях) сульфата меди(II), вступившего в реакцию:
$n(CuSO_4) = \frac{m(CuSO_4)}{M(CuSO_4)} = \frac{36 \text{ г}}{160 \text{ г/моль}} = 0.225 \text{ моль}$
5. По уравнению реакции определим количество вещества образовавшегося осадка $CuS$. Стехиометрические коэффициенты перед $CuSO_4$ и $CuS$ равны 1, следовательно, их количества вещества соотносятся как 1:1.
$n(CuS) = n(CuSO_4) = 0.225 \text{ моль}$
6. Рассчитаем массу осадка сульфида меди(II):
$m(CuS) = n(CuS) \times M(CuS)$
$m(CuS) = 0.225 \text{ моль} \times 96 \text{ г/моль} = 21.6 \text{ г}$
Ответ: масса выпавшего осадка составляет 21,6 г.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 4 расположенного на странице 70 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 70), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















