Номер 3, страница 264 - гдз по физике 10 класс учебник Мякишев, Буховцев

Авторы: Мякишев Г. Я., Буховцев Б. Б., Сотский Н. Н.
Тип: Учебник
Серия: классический курс
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый и углублённый
Цвет обложки: синий
ISBN: 978-5-09-103619-9
Популярные ГДЗ в 10 классе
Глава 13. Основы термодинамики. Параграф 79. Внутренняя энергия. Обсудить в классе - номер 3, страница 264.
№3 (с. 264)
Условие. №3 (с. 264)

Решение. №3 (с. 264)
Решение 3. №3 (с. 264)
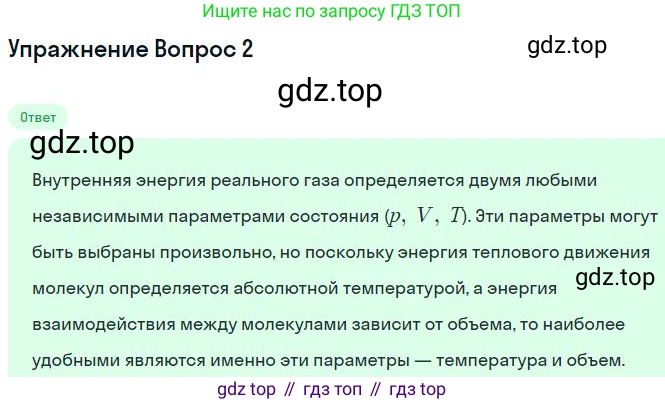
Нет, на основании только того факта, что давление можно выразить через температуру и объём, утверждать зависимость внутренней энергии реального газа от давления нельзя. Такое утверждение было бы логической ошибкой.
Решение
Рассмотрим аргументацию подробнее.
1. Внутренняя энергия любого термодинамического тела (в том числе и газа) является функцией состояния. Это означает, что для определённого состояния системы (которое задаётся, например, парой параметров, такими как температура $T$ и объём $V$) внутренняя энергия $U$ имеет вполне определённое значение. То есть, $U = U(T, V)$.
2. Параметры состояния газа (давление $p$, объём $V$ и температура $T$) не являются независимыми, а связаны между собой уравнением состояния. В общем виде его можно записать как $f(p, V, T) = 0$. Это уравнение позволяет выразить любой из трёх параметров через два других. В частности, давление можно выразить как функцию температуры и объёма: $p = p(T, V)$.
3. Аргумент, предложенный в вопросе, звучит так: раз $p = p(T, V)$, то внутренняя энергия $U$ зависит от $p$. Чтобы проверить состоятельность этого аргумента, применим его к идеальному газу.
- Для идеального газа также существует уравнение состояния (уравнение Менделеева-Клапейрона), из которого следует, что $p = p(T, V)$, а именно $p = \frac{\nu RT}{V}$.
- Однако внутренняя энергия идеального газа, по определению, является суммой кинетических энергий его молекул и не включает потенциальную энергию их взаимодействия (поскольку в модели идеального газа взаимодействием пренебрегают). Кинетическая энергия зависит только от температуры. Следовательно, для идеального газа внутренняя энергия зависит только от температуры: $U = U(T)$.
- Таким образом, для идеального газа, несмотря на то что $p=p(T,V)$, внутренняя энергия $U$ от давления не зависит (при постоянной температуре). Если мы, например, изотермически ($T=const$) изменяем давление идеального газа, его объём тоже меняется ($pV = const$), но внутренняя энергия остаётся неизменной. Это показывает, что сам по себе факт функциональной связи $p=p(T,V)$ не доказывает зависимости $U$ от $p$.
4. Теперь вернёмся к реальному газу.
- Внутренняя энергия реального газа складывается из кинетической энергии движения его молекул и потенциальной энергии их взаимодействия: $U = E_k + E_p$.
- Кинетическая энергия, как и в случае идеального газа, зависит от температуры: $E_k = f(T)$.
- Потенциальная энергия зависит от среднего расстояния между молекулами, то есть от объёма, который занимает газ: $E_p = f(V)$.
- Следовательно, внутренняя энергия реального газа является функцией и температуры, и объёма: $U = U(T, V)$.
5. Зависит ли в итоге внутренняя энергия реального газа от давления? Да, зависит. Поскольку $U$ зависит от объёма $V$, а изменение давления (даже при постоянной температуре) приводит к изменению объёма, то внутренняя энергия будет меняться. Так как мы можем выбрать в качестве независимых переменных любую пару из $(p, V, T)$, например $(p, T)$, то внутреннюю энергию можно представить как функцию давления и температуры: $U = U(p, T)$. Зависимость от давления здесь не равна нулю (в отличие от идеального газа) именно из-за вклада потенциальной энергии взаимодействия молекул.
Таким образом, утверждение "внутренняя энергия реального газа зависит от давления" само по себе верно, но обоснование, предложенное в вопросе, является некорректным, так как оно не раскрывает физическую причину этой зависимости.
Ответ:
Нет, утверждать, что внутренняя энергия реального газа зависит от давления, основываясь только на том, что давление можно выразить через температуру и объём, нельзя. Этот довод является недостаточным и логически неверным, поскольку он применим и к идеальному газу, внутренняя энергия которого от давления (и объёма) не зависит, а определяется только температурой.
На самом деле внутренняя энергия реального газа действительно зависит от давления. Но причина этого в другом: она складывается не только из кинетической энергии молекул (зависящей от температуры), но и из потенциальной энергии их взаимодействия (зависящей от объёма). Поскольку давление, объём и температура связаны уравнением состояния, изменение давления (даже при постоянной температуре) влечёт за собой изменение объёма, а следовательно, и изменение потенциальной энергии, что приводит к изменению всей внутренней энергии. Таким образом, утверждение верно, но по другой физической причине.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по физике за 10 класс, для упражнения номер 3 расположенного на странице 264 к учебнику серии классический курс 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по физике к упражнению №3 (с. 264), авторов: Мякишев (Генадий Яковлевич), Буховцев (Борис Борисович), Сотский (Николай Николаевич), ФГОС (старый) базовый и углублённый уровень обучения учебного пособия издательства Просвещение.




















