Номер 76, страница 301 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 11. Теоретическое описание химических реакций. 11.2. Энтропия и энергия Гиббса. Химическое равновесие. 11.2.1. Энтропия и энергия Гиббса. Уровень 2 - номер 76, страница 301.
№76 (с. 301)
Условие. №76 (с. 301)
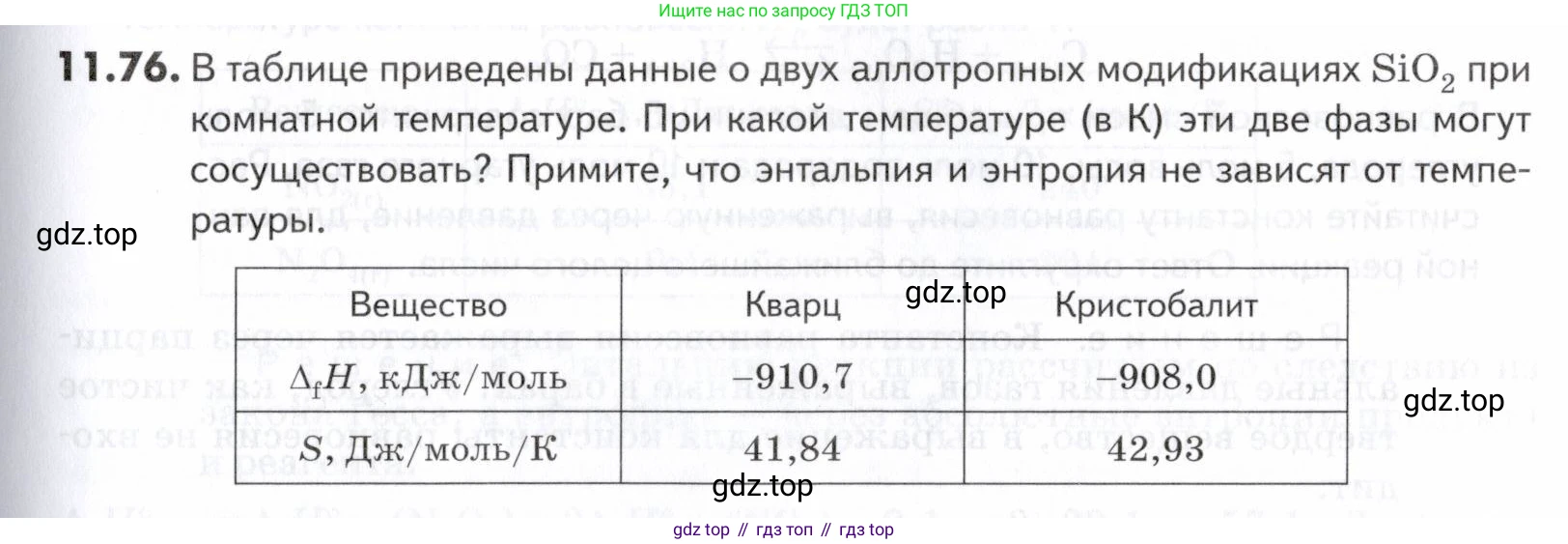
11.76. В таблице приведены данные о двух аллотропных модификациях при комнатной температуре. При какой температуре (в К) эти две фазы могут сосуществовать? Примите, что энтальпия и энтропия не зависят от температуры.
| Вещество | Кварц | Кристобалит |
| кДж/моль | -910,7 | -908,0 |
| S, Дж/моль/К | 41,84 | 42,93 |
Решение 3. №76 (с. 301)
Дано:
Для аллотропной модификации Кварц ($SiO_2$):
Стандартная энтальпия образования $Δ_fH_{кварц} = -910,7$ кДж/моль
Стандартная энтропия $S_{кварц} = 41,84$ Дж/(моль·К)
Для аллотропной модификации Кристобалит ($SiO_2$):
Стандартная энтальпия образования $Δ_fH_{кристобалит} = -908,0$ кДж/моль
Стандартная энтропия $S_{кристобалит} = 42,93$ Дж/(моль·К)
Перевод в систему СИ:
$Δ_fH_{кварц} = -910,7 \cdot 10^3$ Дж/моль = -910700 Дж/моль
$Δ_fH_{кристобалит} = -908,0 \cdot 10^3$ Дж/моль = -908000 Дж/моль
Найти:
Температуру $T$, при которой две фазы могут сосуществовать.
Решение:
Две фазы могут сосуществовать, когда они находятся в термодинамическом равновесии. Условием равновесия для фазового перехода при постоянном давлении и температуре является равенство нулю изменения энергии Гиббса ($ΔG$).
Рассмотрим фазовый переход из кварца в кристобалит:
$SiO_2 (кварц) \rightleftharpoons SiO_2 (кристобалит)$
Изменение энергии Гиббса для этого процесса описывается уравнением:
$ΔG = ΔH - TΔS$
где $ΔH$ — изменение энтальпии, $ΔS$ — изменение энтропии для данного перехода, а $T$ — абсолютная температура.
В состоянии равновесия $ΔG = 0$, следовательно:
$0 = ΔH - TΔS$
Отсюда можно выразить температуру равновесия (сосуществования фаз):
$T = \frac{ΔH}{ΔS}$
Согласно условию задачи, энтальпия и энтропия не зависят от температуры. Рассчитаем изменение энтальпии ($ΔH$) и энтропии ($ΔS$) для перехода кварца в кристобалит, используя предоставленные данные.
Изменение энтальпии:
$ΔH = Δ_fH_{кристобалит} - Δ_fH_{кварц} = -908,0 \text{ кДж/моль} - (-910,7 \text{ кДж/моль}) = 2,7 \text{ кДж/моль}$
Переведем в Дж/моль для согласования единиц:
$ΔH = 2,7 \cdot 1000 \text{ Дж/моль} = 2700 \text{ Дж/моль}$
Изменение энтропии:
$ΔS = S_{кристобалит} - S_{кварц} = 42,93 \text{ Дж/(моль·К)} - 41,84 \text{ Дж/(моль·К)} = 1,09 \text{ Дж/(моль·К)}$
Теперь можем рассчитать температуру, при которой фазы сосуществуют:
$T = \frac{ΔH}{ΔS} = \frac{2700 \text{ Дж/моль}}{1,09 \text{ Дж/(моль·К)}} \approx 2477,06 \text{ К}$
Округлим результат до целого числа.
$T \approx 2477 \text{ К}$
Ответ: 2477 К.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 76 расположенного на странице 301 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №76 (с. 301), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















