Вариант 1, страница 167 - гдз по химии 10 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: коричневый
ISBN: 978-5-09-088084-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 10 классе
Глава IX. Углеводы. Параграф 35. Практическая работа 5. Решение экспериментальных задач на получение и распознавание органических веществ - страница 167.
Вариант 1 (с. 167)
Условие. Вариант 1 (с. 167)
скриншот условия

I вариант
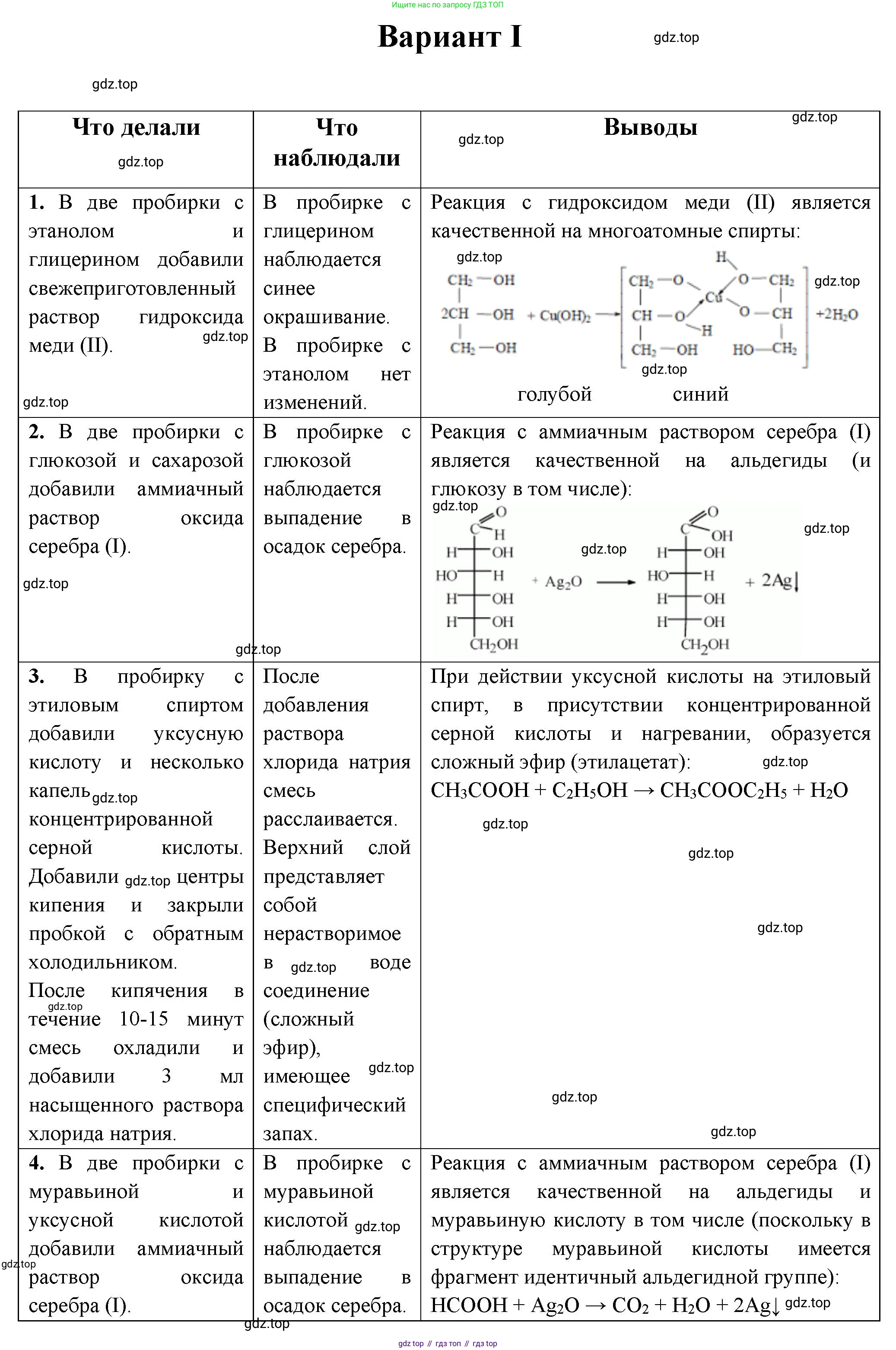
1. В двух пробирках даны вещества: а) этанол; б) глицерин. Проведите опыты, подтверждающие их характерные свойства. Составьте уравнения соответствующих реакций.
2. В двух пробирках даны вещества: а) глюкоза; б) сахароза. Определите эти вещества при помощи характерных химических реакций и приведите соответствующие уравнения реакций.
3. Из этилового спирта получите сложный эфир. Составьте уравнения соответствующих реакций.
4. Даны две пробирки: одна с муравьиной кислотой, другая с уксусной. Определите химическим способом, где находится муравьиная кислота.
5. Докажите опытным путём, что картофель и белый хлеб содержат крахмал.
6. Определите с помощью характерных реакций каждое из трёх предложенных веществ: крахмал, сахар и глюкозу.
7. Выданы пробирки с растворами альдегида и глюкозы. При помощи одних и тех же реактивов определите каждое вещество.
Решение. Вариант 1 (с. 167)
Решение 2. Вариант 1 (с. 167)
1. В двух пробирках даны вещества: а) этанол; б) глицерин. Проведите опыты, подтверждающие их характерные свойства. Составьте уравнения соответствующих реакций.
Решение
Характерным свойством, отличающим многоатомные спирты (глицерин) от одноатомных (этанол), является их реакция со свежеосажденным гидроксидом меди(II). Многоатомные спирты, содержащие гидроксильные группы у соседних атомов углерода, реагируют с $Cu(OH)_2$ с образованием ярко-синего комплексного соединения.
Ход опыта:
- В две пробирки наливаем по 1-2 мл растворов сульфата меди(II) $CuSO_4$.
- В обе пробирки добавляем по 1-2 мл раствора гидроксида натрия $NaOH$. Наблюдаем образование голубого осадка гидроксида меди(II) $Cu(OH)_2$.
Уравнение реакции: $CuSO_4 + 2NaOH \rightarrow Cu(OH)_2 \downarrow + Na_2SO_4$ - В одну пробирку с осадком добавляем этанол, а в другую — глицерин.
- Наблюдения:
- В пробирке с этанолом видимых изменений не происходит.
- В пробирке с глицерином голубой осадок $Cu(OH)_2$ растворяется, и образуется прозрачный раствор ярко-синего (василькового) цвета — глицерат меди(II).
Уравнение реакции для глицерина:
$2C_3H_5(OH)_3 + Cu(OH)_2 \rightarrow$ $ + 2H_2O $
Ответ: Чтобы различить этанол и глицерин, нужно провести качественную реакцию на многоатомные спирты с гидроксидом меди(II). Глицерин даст ярко-синее окрашивание, а этанол не прореагирует.
2. В двух пробирках даны вещества: а) глюкоза; б) сахароза. Определите эти вещества при помощи характерных химических реакций и приведите соответствующие уравнения реакций.
Решение
Глюкоза является альдегидоспиртом, то есть содержит альдегидную группу, в то время как у сахарозы (дисахарида) такая группа отсутствует. Это различие позволяет идентифицировать их с помощью реакций на альдегидную группу.
Опыт 1: Реакция с гидроксидом меди(II) при нагревании.
- К растворам глюкозы и сахарозы в двух разных пробирках добавляем по несколько капель раствора $CuSO_4$ и избыток раствора $NaOH$. В обеих пробирках образуется ярко-синий раствор, так как оба вещества являются многоатомными спиртами. Этот этап не позволяет их различить.
- Нагреваем содержимое обеих пробирок.
- Наблюдения:
- В пробирке с глюкозой синяя окраска сменяется на желтую ($CuOH$), а затем на красно-оранжевую из-за образования осадка оксида меди(I) ($Cu_2O$). Глюкоза окисляется до глюконовой кислоты.
- В пробирке с сахарозой при нагревании цвет не изменяется (или раствор темнеет из-за частичного разложения сахарозы).
Уравнение реакции для глюкозы:
$ CH_2OH-(CHOH)_4-CHO + 2Cu(OH)_2 \xrightarrow{t^\circ} CH_2OH-(CHOH)_4-COOH + Cu_2O\downarrow + 2H_2O $
Опыт 2: Реакция «серебряного зеркала».
- К растворам глюкозы и сахарозы добавляем аммиачный раствор оксида серебра (реактив Толленса) и осторожно нагреваем на водяной бане.
- Наблюдения:
- В пробирке с глюкозой на стенках образуется блестящий налет металлического серебра («серебряное зеркало»).
- В пробирке с сахарозой видимых изменений не происходит.
Уравнение реакции для глюкозы:
$ CH_2OH-(CHOH)_4-CHO + 2[Ag(NH_3)_2]OH \xrightarrow{t^\circ} CH_2OH-(CHOH)_4-COONH_4 + 2Ag\downarrow + 3NH_3 + H_2O $
Ответ: Глюкозу можно определить по реакции «серебряного зеркала» или по образованию красного осадка $Cu_2O$ при нагревании с гидроксидом меди(II). Сахароза не вступает в эти реакции.
3. Из этилового спирта получите сложный эфир. Составьте уравнения соответствующих реакций.
Решение
Сложные эфиры получают в результате реакции этерификации — взаимодействия спиртов с карбоновыми кислотами. Для получения сложного эфира из этилового спирта ($C_2H_5OH$) можно использовать, например, уксусную кислоту ($CH_3COOH$). Реакция проводится в присутствии концентрированной серной кислоты ($H_2SO_4$) в качестве катализатора и водоотнимающего средства.
Ход опыта:
- В сухую пробирку наливаем 2 мл этилового спирта и 2 мл ледяной уксусной кислоты.
- Осторожно добавляем 0.5 мл концентрированной серной кислоты.
- Пробирку аккуратно нагреваем на водяной бане.
- После нагревания содержимое пробирки выливаем в стакан с холодной водой. Ощущается характерный приятный запах (часто описывается как грушевый или яблочный), который принадлежит образовавшемуся сложному эфиру — этилацетату.
Уравнение реакции этерификации:
$CH_3COOH + HOC_2H_5 \rightleftharpoons CH_3COOC_2H_5 + H_2O$
(уксусная кислота + этанол $\rightleftharpoons$ этилацетат + вода)
Ответ: Для получения сложного эфира (этилацетата) из этилового спирта нужно провести реакцию этерификации с уксусной кислотой в присутствии концентрированной серной кислоты при нагревании.
4. Даны две пробирки: одна с муравьиной кислотой, другая с уксусной. Определите химическим способом, где находится муравьиная кислота.
Решение
Молекула муравьиной кислоты ($HCOOH$) уникальна тем, что она содержит как карбоксильную группу ($-COOH$), так и альдегидную группу ($H-C=O$). Это позволяет ей вступать в реакции окисления, характерные для альдегидов, в отличие от уксусной кислоты ($CH_3COOH$), у которой альдегидной группы нет.
Способ 1: Реакция с аммиачным раствором оксида серебра (реактив Толленса).
При добавлении к обоим растворам реактива Толленса и нагревании, муравьиная кислота окислится, что приведет к выпадению металлического серебра в виде «серебряного зеркала». Уксусная кислота в эту реакцию не вступает.
Уравнение реакции для муравьиной кислоты:
$HCOOH + 2[Ag(NH_3)_2]OH \xrightarrow{t^\circ} (NH_4)_2CO_3 + 2Ag\downarrow + 2NH_3 + H_2O$
(промежуточно образующаяся угольная кислота $H_2CO_3$ реагирует с аммиаком, образуя карбонат аммония)
Способ 2: Реакция с гидроксидом меди(II) при нагревании.
При нагревании с $Cu(OH)_2$ муравьиная кислота, проявляя свойства альдегида, восстановит медь(II) до меди(I), что проявится в виде образования красно-оранжевого осадка $Cu_2O$. Уксусная кислота даст лишь синий раствор ацетата меди(II).
Уравнение реакции для муравьиной кислоты:
$HCOOH + 2Cu(OH)_2 \xrightarrow{t^\circ} CO_2\uparrow + Cu_2O\downarrow + 3H_2O$
Ответ: Муравьиную кислоту можно определить с помощью реактива Толленса (выпадает серебро) или при нагревании с $Cu(OH)_2$ (выпадает красный осадок $Cu_2O$). Уксусная кислота не дает этих реакций.
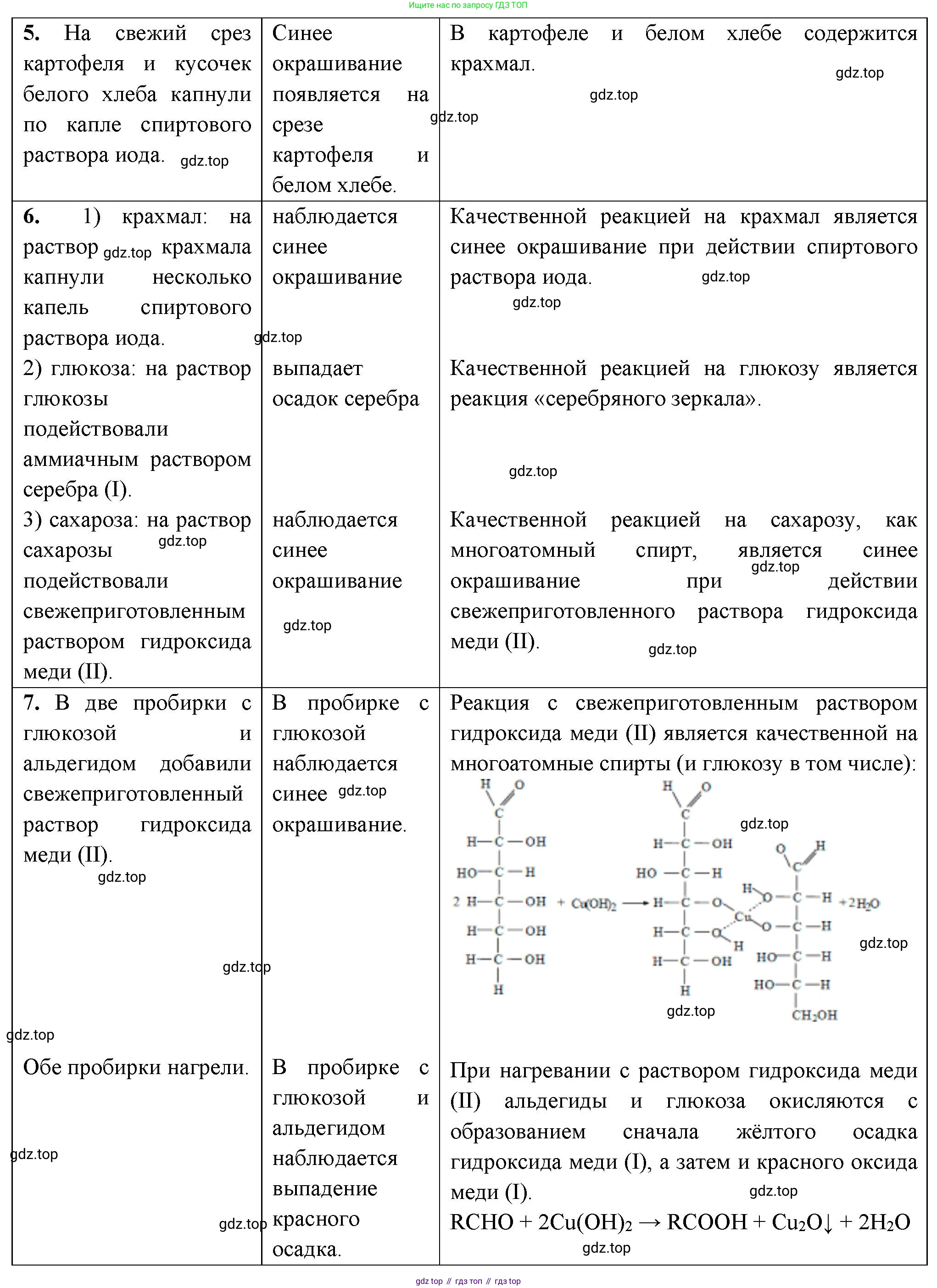
5. Докажите опытным путём, что картофель и белый хлеб содержат крахмал.
Решение
Качественной реакцией на крахмал является его взаимодействие с иодом. Крахмал состоит из амилозы и амилопектина. Молекулы амилозы имеют спиральную структуру, в которую могут встраиваться молекулы иода, образуя так называемый комплекс включения, имеющий характерную интенсивную сине-фиолетовую окраску.
Ход опыта:
- Берем срез сырого картофеля и кусочек белого хлеба.
- Готовим реактив — спиртовой раствор иода (аптечная иодная настойка) или раствор Люголя (водный раствор иода в иодиде калия).
- Наносим по капле раствора иода на срез картофеля и на мякиш белого хлеба.
- Наблюдения: В месте нанесения капли иода на обоих образцах появляется интенсивное сине-фиолетовое (почти черное) окрашивание.
Этот результат однозначно свидетельствует о наличии крахмала в картофеле и белом хлебе.
Ответ: При нанесении раствора иода на срез картофеля и на белый хлеб появляется характерное сине-фиолетовое окрашивание, что доказывает наличие в них крахмала.
6. Определите с помощью характерных реакций каждое из трёх предложенных веществ: крахмал, сахар и глюкозу.
Решение
Для определения этих трех углеводов (предполагается, что "сахар" - это сахароза) нужно провести последовательность качественных реакций.
План определения:
- Этап 1: Определение крахмала.
Во все три пробирки с растворами (или порошками) исследуемых веществ добавляем по капле раствора иода.
Результат: В пробирке, где появилось сине-фиолетовое окрашивание, находится крахмал. Две другие пробирки отставляем для следующего этапа. - Этап 2: Определение глюкозы и сахарозы.
В две оставшиеся пробирки добавляем по 1 мл свежеосажденного гидроксида меди(II) $Cu(OH)_2$. В обеих пробирках образуются ярко-синие растворы (качественная реакция на многоатомные спирты). Затем обе пробирки нагреваем.
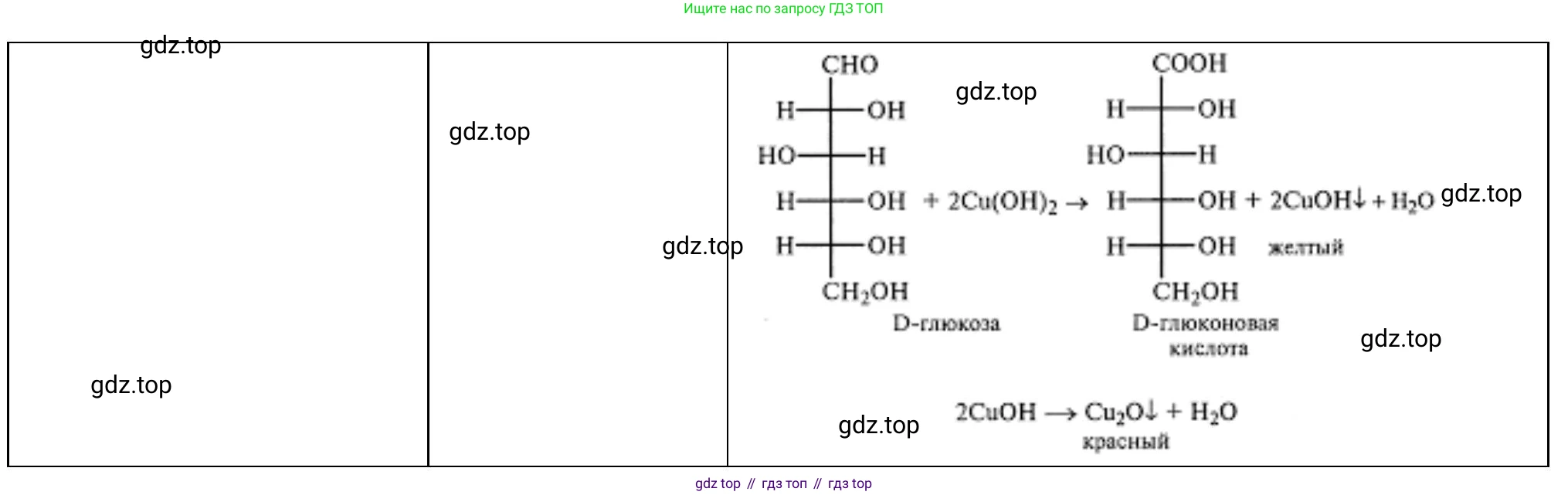
Результат:- В пробирке, где при нагревании выпадает красно-оранжевый осадок оксида меди(I) ($Cu_2O$), находится глюкоза (реакция на альдегидную группу).
Уравнение: $ C_6H_{12}O_6 + 2Cu(OH)_2 \xrightarrow{t^\circ} C_6H_{12}O_7 + Cu_2O\downarrow + 2H_2O $ (глюконовая кислота) - В пробирке, где при нагревании цвет не меняется (раствор остается синим), находится сахароза, так как она не имеет свободной альдегидной группы.
- В пробирке, где при нагревании выпадает красно-оранжевый осадок оксида меди(I) ($Cu_2O$), находится глюкоза (реакция на альдегидную группу).
Ответ: Крахмал определяется по синему окрашиванию с иодом. Глюкоза и сахароза различаются по реакции с $Cu(OH)_2$ при нагревании: глюкоза дает красный осадок $Cu_2O$, а сахароза не реагирует.
7. Выданы пробирки с растворами альдегида и глюкозы. При помощи одних и тех же реактивов определите каждое вещество.
Решение
И альдегид (например, уксусный альдегид $CH_3CHO$), и глюкоза содержат альдегидную группу ($-CHO$). Однако глюкоза, в отличие от простого альдегида, является также многоатомным спиртом. Это свойство можно использовать для их различения. В качестве единого реактива можно использовать гидроксид меди(II) $Cu(OH)_2$.
Ход опыта:
- Этап 1: Реакция при комнатной температуре (без нагревания).
В обе пробирки добавляем свежеосажденный гидроксид меди(II).
Наблюдения:- В пробирке с глюкозой голубой осадок $Cu(OH)_2$ растворяется с образованием прозрачного раствора ярко-синего цвета. Это качественная реакция на многоатомные спирты.
- В пробирке с альдегидом (например, формальдегидом или ацетальдегидом) никаких изменений не происходит, голубой осадок $Cu(OH)_2$ сохраняется.
Уравнение реакции для глюкозы (как многоатомного спирта):
$ 2C_6H_{12}O_6 + Cu(OH)_2 \rightarrow (C_6H_{11}O_6)_2Cu + 2H_2O $ (упрощенная схема) - Этап 2: Реакция при нагревании (для подтверждения).
Теперь нагреем обе пробирки.
Наблюдения:- В обеих пробирках выпадает красно-оранжевый осадок оксида меди(I) ($Cu_2O$). Это подтверждает наличие альдегидной группы в обоих веществах.
Уравнение реакции для альдегида (R-CHO) при нагревании:
$ R-CHO + 2Cu(OH)_2 \xrightarrow{t^\circ} R-COOH + Cu_2O\downarrow + 2H_2O $
Таким образом, уже на первом этапе, без нагревания, вещества можно было различить.
Ответ: С помощью гидроксида меди(II) $Cu(OH)_2$ можно различить альдегид и глюкозу. При комнатной температуре глюкоза растворит осадок $Cu(OH)_2$ с образованием ярко-синего раствора (как многоатомный спирт), а альдегид не прореагирует. При последующем нагревании оба вещества дадут красный осадок $Cu_2O$ (как альдегиды).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения Вариант 1 расположенного на странице 167 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Вариант 1 (с. 167), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.



















