Вариант 2, страница 167 - гдз по химии 10 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: коричневый
ISBN: 978-5-09-088084-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 10 классе
Глава IX. Углеводы. Параграф 35. Практическая работа 5. Решение экспериментальных задач на получение и распознавание органических веществ - страница 167.
Вариант 2 (с. 167)
Условие. Вариант 2 (с. 167)
скриншот условия


II вариант
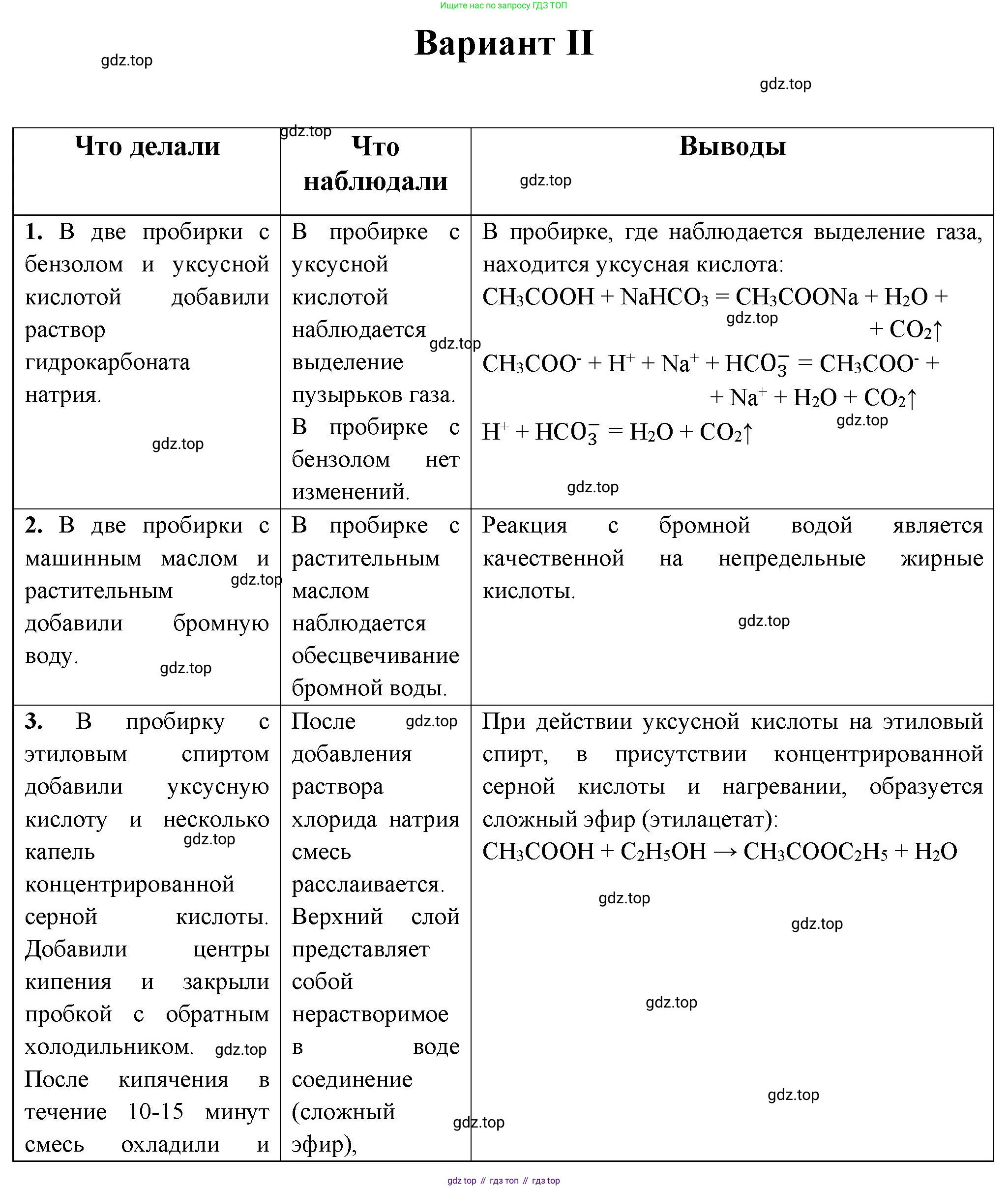
1. Даны две пробирки: одна с бензолом, другая с уксусной кислотой. Проведите опыты, подтверждающие характерные свойства данных веществ. Приведите уравнения соответствующих реакций. Уравнения реакций с уксусной кислотой напишите в молекулярном, полном и сокращённом ионном виде.
2. В одной пробирке содержится машинное масло, полученное из нефти, в другой — растительное масло. Определите химическим способом, где какое масло находится.
3. Из этилового спирта получите сложный эфир. Составьте уравнения соответствующих реакций.
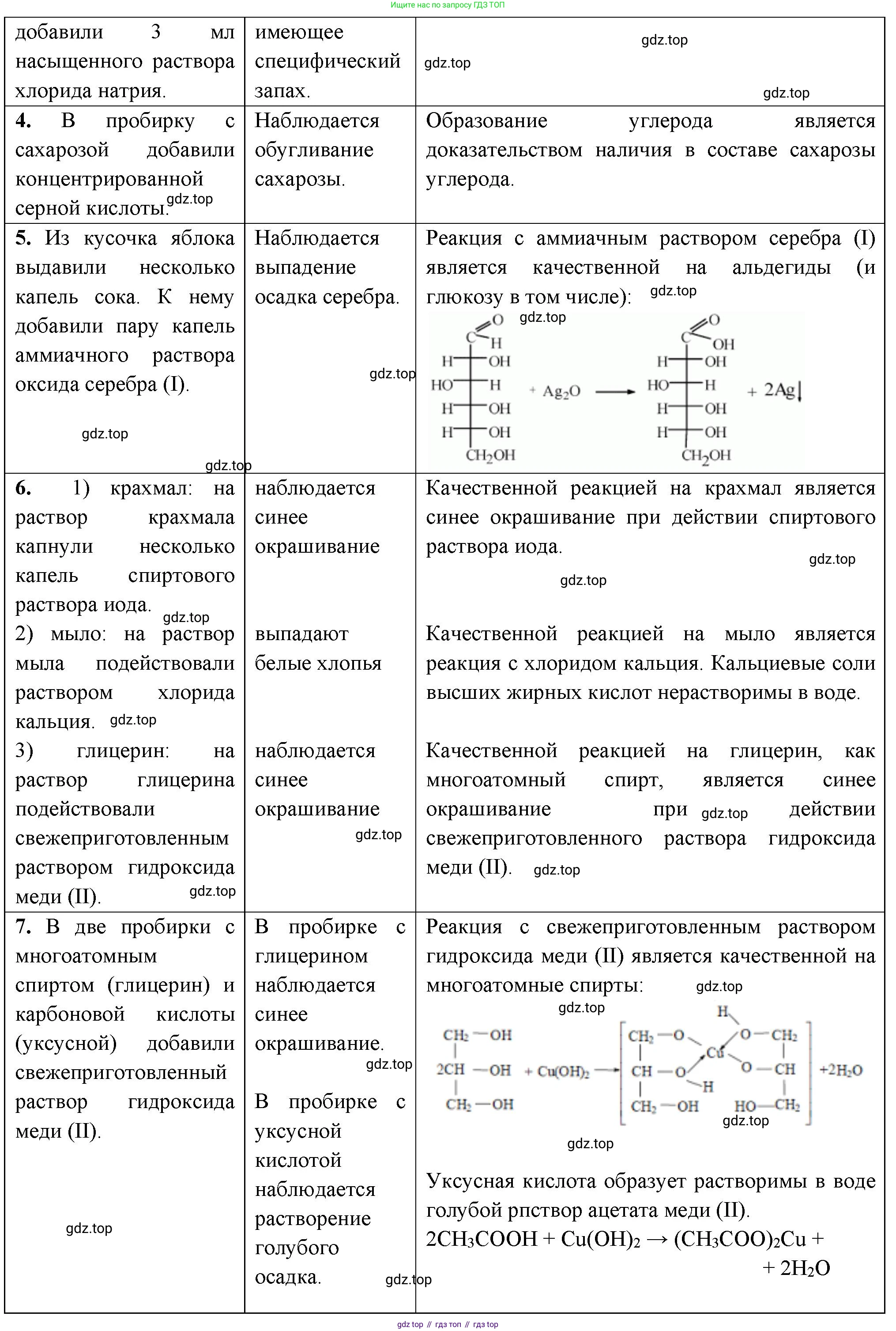
4. Докажите на опыте, что обычный сахар содержит углерод.
5. Докажите опытным путём, что спелое яблоко содержит глюкозу.
6. Определите с помощью характерных реакций каждое из трёх предложенных веществ: глицерин, мыло и крахмал (растворы).
7. Докажите опытным путём, что выданное вам вещество: а) многоатомный спирт; б) карбоновая кислота. Используйте только один реактив.
Отчёт о работе оформите в виде таблицы (см. § 3).
Решение. Вариант 2 (с. 167)
Решение 2. Вариант 2 (с. 167)
1. Решение:
Для определения веществ в пробирках (бензол и уксусная кислота) можно провести качественные реакции, основанные на их химических свойствах. Уксусная кислота проявляет свойства карбоновых кислот, а бензол — ароматических углеводородов.
Опыт для определения уксусной кислоты.
Уксусная кислота, как и все кислоты, реагирует с солями более слабых кислот, например, с карбонатами. При добавлении в пробирку с уксусной кислотой раствора карбоната натрия ($Na_2CO_3$) будет наблюдаться бурное выделение бесцветного газа без запаха — углекислого газа ($CO_2$). Бензол в такую реакцию не вступает.
Уравнения реакции с уксусной кислотой:
Молекулярное уравнение:
$2CH_3COOH + Na_2CO_3 \rightarrow 2CH_3COONa + H_2O + CO_2\uparrow$
Полное ионное уравнение (уксусная кислота — слабый электролит, поэтому записывается в молекулярной форме):
$2CH_3COOH + 2Na^+ + CO_3^{2-} \rightarrow 2CH_3COO^- + 2Na^+ + H_2O + CO_2\uparrow$
Сокращённое ионное уравнение:
$2CH_3COOH + CO_3^{2-} \rightarrow 2CH_3COO^- + H_2O + CO_2\uparrow$
Опыт для подтверждения свойств бензола.
Бензол, в отличие от непредельных углеводородов, не обесцвечивает раствор перманганата калия. Характерным свойством бензола является его горение с образованием большого количества копоти, что свидетельствует о высоком процентном содержании углерода в его молекуле.
$2C_6H_6 + 15O_2 \rightarrow 12CO_2 + 6H_2O$
Ответ: Чтобы различить бензол и уксусную кислоту, нужно добавить в обе пробирки раствор карбоната натрия. В пробирке с уксусной кислотой будет наблюдаться выделение газа. Уравнения реакции: молекулярное – $2CH_3COOH + Na_2CO_3 \rightarrow 2CH_3COONa + H_2O + CO_2\uparrow$; полное ионное – $2CH_3COOH + 2Na^+ + CO_3^{2-} \rightarrow 2CH_3COO^- + 2Na^+ + H_2O + CO_2\uparrow$; сокращённое ионное – $2CH_3COOH + CO_3^{2-} \rightarrow 2CH_3COO^- + H_2O + CO_2\uparrow$.
2. Решение:
Машинное масло является продуктом переработки нефти и состоит из предельных углеводородов. Растительное масло — это смесь триглицеридов, в состав которых входят остатки непредельных жирных кислот, содержащие двойные связи $C=C$. Именно наличие этих кратных связей позволяет химически отличить растительное масло от машинного.
Для этого можно использовать качественную реакцию на непредельные соединения, например, с раствором перманганата калия ($KMnO_4$).
Опыт: В обе пробирки налить по 1-2 мл исследуемых масел и добавить несколько капель фиолетового раствора перманганата калия, затем энергично встряхнуть.
Наблюдения:
- В пробирке с растительным маслом произойдет быстрое обесцвечивание раствора $KMnO_4$, так как он вступает в реакцию окисления по месту двойных связей.
- В пробирке с машинным маслом (предельные углеводороды) реакции не будет, и фиолетовая окраска раствора сохранится.
Ответ: Для определения масел нужно в обе пробирки добавить водный раствор перманганата калия и встряхнуть. В пробирке с растительным маслом произойдет обесцвечивание раствора, а в пробирке с машинным маслом цвет не изменится.
3. Решение:
Сложные эфиры получают в реакции этерификации — взаимодействия спиртов с карбоновыми кислотами. Для получения сложного эфира из этилового спирта ($C_2H_5OH$) необходимо провести его реакцию с какой-либо карбоновой кислотой, например, с уксусной ($CH_3COOH$).
Реакция проводится при нагревании и в присутствии катализатора — концентрированной серной кислоты ($H_2SO_4$), которая также является водоотнимающим средством и смещает равновесие в сторону образования продуктов.
В результате реакции образуется этилацетат (этиловый эфир уксусной кислоты) — летучая жидкость с характерным фруктовым запахом.
Уравнение реакции этерификации:
$CH_3COOH + C_2H_5OH \overset{H_2SO_4, t}{\rightleftharpoons} CH_3COOC_2H_5 + H_2O$
Ответ: Для получения сложного эфира из этилового спирта необходимо провести его реакцию с уксусной кислотой в присутствии концентрированной серной кислоты при нагревании. Уравнение реакции: $CH_3COOH + C_2H_5OH \overset{H_2SO_4, t}{\rightleftharpoons} CH_3COOC_2H_5 + H_2O$.
4. Решение:
Обычный сахар (сахароза, $C_{12}H_{22}O_{11}$) является органическим веществом, в состав которого входят атомы углерода, водорода и кислорода. Доказать наличие углерода можно, удалив из молекулы сахарозы водород и кислород в виде воды. Этот процесс называется дегидратацией.
Опыт: В термостойкий стакан насыпать немного сахара и осторожно прилить концентрированную серную кислоту ($H_2SO_4$). Серная кислота является сильным водоотнимающим средством. Она отщепляет от молекулы сахарозы воду, в результате чего остается чистый углерод в виде черной пористой массы, которая увеличивается в объеме за счет выделяющихся газов (продуктов окисления углерода серной кислотой).
Уравнение реакции дегидратации сахарозы:
$C_{12}H_{22}O_{11} \xrightarrow{H_2SO_4 (конц.)} 12C + 11H_2O$
Ответ: Необходимо к небольшому количеству сахара добавить концентрированную серную кислоту. Наблюдаемое почернение (обугливание) вещества доказывает наличие углерода в составе сахара.
5. Решение:
Спелое яблоко содержит глюкозу ($C_6H_{12}O_6$), которая по своей химической природе является альдегидоспиртом, то есть содержит и гидроксильные, и альдегидную группы. Доказать наличие глюкозы можно с помощью качественной реакции на альдегидную группу.
Опыт: Реакция с гидроксидом меди(II) ($Cu(OH)_2$).
1. Сначала нужно получить яблочный сок, отжав его из натертой мякоти яблока.
2. В пробирке получают свежеосажденный гидроксид меди(II) ($Cu(OH)_2$) голубого цвета, добавляя к раствору сульфата меди(II) раствор щелочи.
3. К осадку $Cu(OH)_2$ добавляют яблочный сок. Осадок растворяется, образуя прозрачный раствор ярко-синего цвета. Это подтверждает наличие в соке многоатомного спирта (глюкоза им является).
4. Полученный синий раствор нагревают. Происходит окисление альдегидной группы глюкозы, а медь(II) восстанавливается до меди(I). Раствор меняет цвет, и выпадает характерный кирпично-красный осадок оксида меди(I) ($Cu_2O$).
Упрощенное уравнение реакции окисления глюкозы:
$CH_2OH-(CHOH)_4-CHO + 2Cu(OH)_2 \xrightarrow{t} CH_2OH-(CHOH)_4-COOH \text{ (глюконовая кислота)} + Cu_2O\downarrow + 2H_2O$
Ответ: К свежеосажденному гидроксиду меди(II) нужно добавить яблочный сок. Растворение осадка и образование ярко-синего раствора, который при нагревании дает кирпично-красный осадок, доказывает наличие глюкозы в яблоке.
6. Решение:
Для распознавания растворов глицерина, мыла и крахмала нужно последовательно применить качественные реактивы на каждый из них.
1. Определение крахмала. Реактивом на крахмал является раствор йода. Нужно во все три пробирки добавить по капле раствора йода. В той пробирке, где раствор окрасится в интенсивный синий цвет, находится крахмал.
2. Определение глицерина. Глицерин — многоатомный спирт. Качественной реакцией на многоатомные спирты является взаимодействие со свежеосажденным гидроксидом меди(II). В две оставшиеся пробирки нужно добавить $Cu(OH)_2$ (голубой осадок). В пробирке с глицерином осадок растворится, образовав прозрачный раствор васильково-синего цвета (глицерат меди(II)).
3. Определение мыла. В последней пробирке остался раствор мыла. Мыло — это натриевая или калиевая соль высшей карбоновой кислоты. Его водный раствор имеет щелочную среду из-за гидролиза по аниону ($R-COO^- + H_2O \rightleftharpoons R-COOH + OH^-$). Это можно подтвердить, добавив в пробирку каплю индикатора фенолфталеина, который в щелочной среде станет малиновым.
Ответ: Крахмал определяется по синему окрашиванию с раствором йода. Глицерин — по образованию ярко-синего раствора со свежеосажденным гидроксидом меди(II). Мыло — по щелочной реакции среды, которую можно определить с помощью индикатора (например, фенолфталеина).
7. Решение:
Задача состоит из двух частей, для каждой из которых нужно подобрать один специфический реактив.
а) Докажите опытным путём, что выданное вам вещество — многоатомный спирт.
Реактив: Свежеосажденный гидроксид меди(II) ($Cu(OH)_2$).
Опыт: К исследуемому веществу (в виде раствора) добавляют несколько капель раствора сульфата меди(II) и избыток раствора щелочи. Если образующийся голубой осадок гидроксида меди(II) растворяется и образуется прозрачный раствор ярко-синего цвета, то исследуемое вещество является многоатомным спиртом (с гидроксогруппами у соседних атомов углерода).
б) Докажите опытным путём, что выданное вам вещество — карбоновая кислота.
Реактив: Раствор карбоната (например, $Na_2CO_3$) или гидрокарбоната натрия ($NaHCO_3$).
Опыт: К раствору исследуемого вещества добавляют раствор карбоната натрия. Если наблюдается "вскипание" — бурное выделение пузырьков газа ($CO_2$), — это доказывает, что вещество является кислотой, более сильной, чем угольная.
Ответ:
а) Чтобы доказать, что вещество — многоатомный спирт, нужно использовать свежеосажденный гидроксид меди(II). Признак реакции — растворение осадка $Cu(OH)_2$ с образованием ярко-синего раствора.
б) Чтобы доказать, что вещество — карбоновая кислота, нужно использовать раствор карбоната натрия. Признак реакции — выделение углекислого газа.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения Вариант 2 расположенного на странице 167 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Вариант 2 (с. 167), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.




















