Номер 8, страница 318 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 6. Теоретическое описание химических реакций. Параграф 67. Химическое равновесие в растворах - номер 8, страница 318.
№8 (с. 318)
Условие. №8 (с. 318)
скриншот условия

8. Никотиновая кислота — биологически активное вещество, витамин PP. Это — одноосновная кислота с константой диссоциации $K = 1,5 \cdot 10^{-5}$. Рассчитайте концентрацию ионов водорода и pH раствора, полученного при добавлении 0,1 моль кислоты к одному литру воды. Определите степень диссоциации кислоты в этом растворе.
Решение. №8 (с. 318)
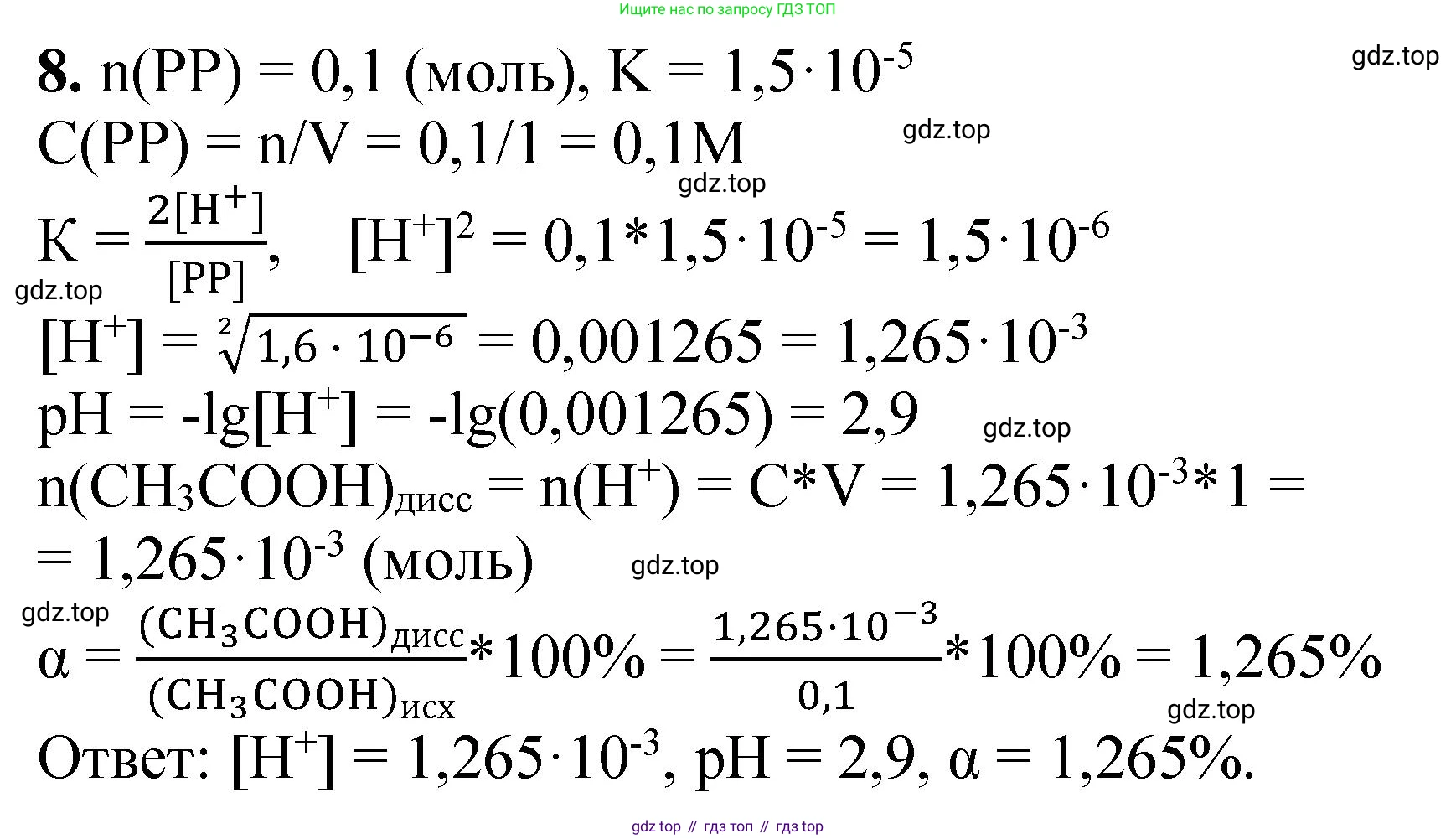
Решение 2. №8 (с. 318)
Дано:
Константа диссоциации никотиновой кислоты $K = 1.5 \cdot 10^{-5}$
Количество вещества кислоты $n = 0.1 \text{ моль}$
Объем воды $V = 1 \text{ л}$
Найти:
Концентрацию ионов водорода $[H^+]$
Водородный показатель $pH$
Степень диссоциации $\alpha$
Решение:
1. Сначала определим начальную молярную концентрацию ($C$) никотиновой кислоты в растворе. Предполагая, что объем раствора равен объему добавленной воды, получаем:
$C = \frac{n}{V} = \frac{0.1 \text{ моль}}{1 \text{ л}} = 0.1 \text{ моль/л}$
2. Никотиновая кислота (обозначим ее формулой $HA$) является слабой одноосновной кислотой и диссоциирует в воде по уравнению:
$HA \rightleftharpoons H^+ + A^-$
3. Константа диссоциации ($K$) для этой реакции выражается как:
$K = \frac{[H^+][A^-]}{[HA]}$
В состоянии равновесия концентрации ионов $[H^+]$ и $[A^-]$ равны, а концентрация недиссоциированной кислоты $[HA]$ равна начальной концентрации $C$ минус концентрация продиссоциировавших ионов: $[H^+] = [A^-]$ и $[HA] = C - [H^+]$.
Тогда уравнение для $K$ принимает вид:
$K = \frac{[H^+]^2}{C - [H^+]}$
4. Поскольку никотиновая кислота является слабой ($K$ мало), можно сделать допущение, что степень ее диссоциации мала, и, следовательно, равновесная концентрация $[H^+]$ значительно меньше начальной концентрации кислоты $C$. Это позволяет упростить знаменатель: $C - [H^+] \approx C$.
$K \approx \frac{[H^+]^2}{C}$
5. Теперь мы можем рассчитать концентрацию ионов водорода $[H^+]$:
$[H^+] = \sqrt{K \cdot C} = \sqrt{1.5 \cdot 10^{-5} \cdot 0.1} = \sqrt{1.5 \cdot 10^{-6}} \approx 1.225 \cdot 10^{-3} \text{ моль/л}$
Проверим сделанное допущение: степень диссоциации составляет $\frac{1.225 \cdot 10^{-3}}{0.1} \cdot 100\% = 1.225\%$. Так как это значение меньше 5%, допущение является корректным.
6. Рассчитаем водородный показатель $pH$, используя не округленное значение $[H^+]$ для большей точности:
$pH = -\lg[H^+] = -\lg(1.225 \cdot 10^{-3}) \approx 2.91$
7. Определим степень диссоциации кислоты ($\alpha$), которая равна отношению концентрации ионов водорода к начальной концентрации кислоты:
$\alpha = \frac{[H^+]}{C} = \frac{1.225 \cdot 10^{-3} \text{ моль/л}}{0.1 \text{ моль/л}} \approx 0.01225$
Приводя ответы к двум значащим цифрам (как в исходной константе $K=1.5 \cdot 10^{-5}$), получаем:
$[H^+] \approx 1.2 \cdot 10^{-3} \text{ моль/л}$
$pH \approx 2.91$ (для pH принято оставлять два знака после запятой)
$\alpha \approx 0.012$ (или $1.2\%$)
Ответ: концентрация ионов водорода $[H^+] \approx 1.2 \cdot 10^{-3}$ моль/л, $pH \approx 2.91$, степень диссоциации $\alpha \approx 0.012$ (или $1.2\%$).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 8 расположенного на странице 318 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №8 (с. 318), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















