Номер 3, страница 258 - гдз по химии 8 класс учебник Габриелян

Авторы: Габриелян О. С.
Тип: Учебник
Издательство: Просвещение
Год издания: 2021 - 2025
Цвет обложки: белый
ISBN: 978-5-09-105083-7
Популярные ГДЗ в 8 классе
Глава 5. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции. Параграф 42. Соли, их классификация и свойства - номер 3, страница 258.
№3 (с. 258)
Условие. №3 (с. 258)

Решение. №3 (с. 258)

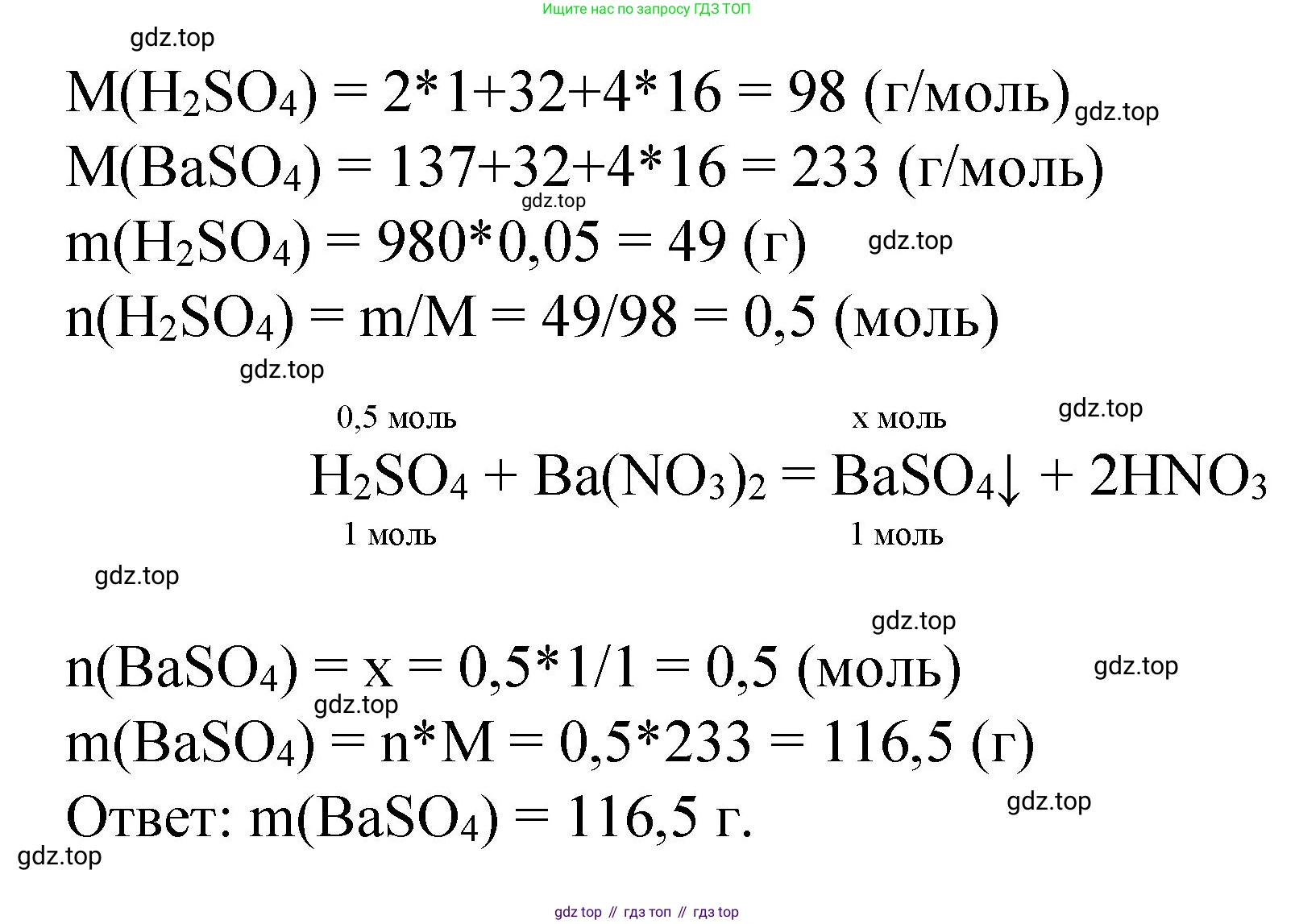
Решение 2. №3 (с. 258)
Дано:
$\omega(H_2SO_4) = 5\% = 0.05$
$m_{р-ра}(H_2SO_4) = 980 \text{ г}$
Раствор $Ba(NO_3)_2$ в избытке
Найти:
$m(\text{осадка}) - ?$
Решение:
1. Для решения задачи сначала необходимо написать уравнение химической реакции. При взаимодействии раствора серной кислоты ($H_2SO_4$) с раствором нитрата бария ($Ba(NO_3)_2$) происходит реакция ионного обмена, в результате которой образуется нерастворимый в воде сульфат бария ($BaSO_4$), который выпадает в осадок, и азотная кислота ($HNO_3$).
$H_2SO_4 + Ba(NO_3)_2 \rightarrow BaSO_4 \downarrow + 2HNO_3$
2. По условию задачи, раствор нитрата бария взят в избытке. Это означает, что вся серная кислота в растворе прореагирует полностью, и расчет массы осадка нужно вести по серной кислоте.
3. Найдем массу чистой серной кислоты, содержащейся в 980 г 5%-го раствора. Для этого умножим массу раствора на массовую долю кислоты:
$m(H_2SO_4) = m_{р-ра}(H_2SO_4) \times \omega(H_2SO_4) = 980 \text{ г} \times 0.05 = 49 \text{ г}$
4. Далее рассчитаем количество вещества (в молях) серной кислоты. Для этого найдем молярную массу $H_2SO_4$ и разделим массу вещества на молярную массу.
Молярная масса серной кислоты:
$M(H_2SO_4) = 2 \times M(H) + M(S) + 4 \times M(O) = 2 \times 1 + 32 + 4 \times 16 = 98 \text{ г/моль}$
Количество вещества серной кислоты:
$n(H_2SO_4) = \frac{m(H_2SO_4)}{M(H_2SO_4)} = \frac{49 \text{ г}}{98 \text{ г/моль}} = 0.5 \text{ моль}$
5. По уравнению реакции, стехиометрические коэффициенты перед серной кислотой и сульфатом бария равны 1. Это значит, что из 1 моль серной кислоты образуется 1 моль сульфата бария.
$n(H_2SO_4) : n(BaSO_4) = 1 : 1$
Следовательно, количество вещества выпавшего осадка ($BaSO_4$) равно количеству вещества прореагировавшей серной кислоты:
$n(BaSO_4) = n(H_2SO_4) = 0.5 \text{ моль}$
6. Теперь найдем массу осадка ($BaSO_4$). Для этого рассчитаем его молярную массу и умножим на количество вещества.
Молярная масса сульфата бария:
$M(BaSO_4) = M(Ba) + M(S) + 4 \times M(O) = 137 + 32 + 4 \times 16 = 233 \text{ г/моль}$
Масса осадка:
$m(BaSO_4) = n(BaSO_4) \times M(BaSO_4) = 0.5 \text{ моль} \times 233 \text{ г/моль} = 116.5 \text{ г}$
Ответ: масса выпавшего осадка составляет 116.5 г.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 3 расположенного на странице 258 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 258), автора: Габриелян (Олег Саргисович), ФГОС (старый) учебного пособия издательства Просвещение.
















