Номер 4, страница 258 - гдз по химии 8 класс учебник Габриелян

Авторы: Габриелян О. С.
Тип: Учебник
Издательство: Просвещение
Год издания: 2021 - 2026
Цвет обложки: белый
ISBN: 978-5-09-105083-7
Популярные ГДЗ в 8 классе
Глава 5. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции. Параграф 42. Соли, их классификация и свойства - номер 4, страница 258.
№4 (с. 258)
Условие. №4 (с. 258)

Решение. №4 (с. 258)
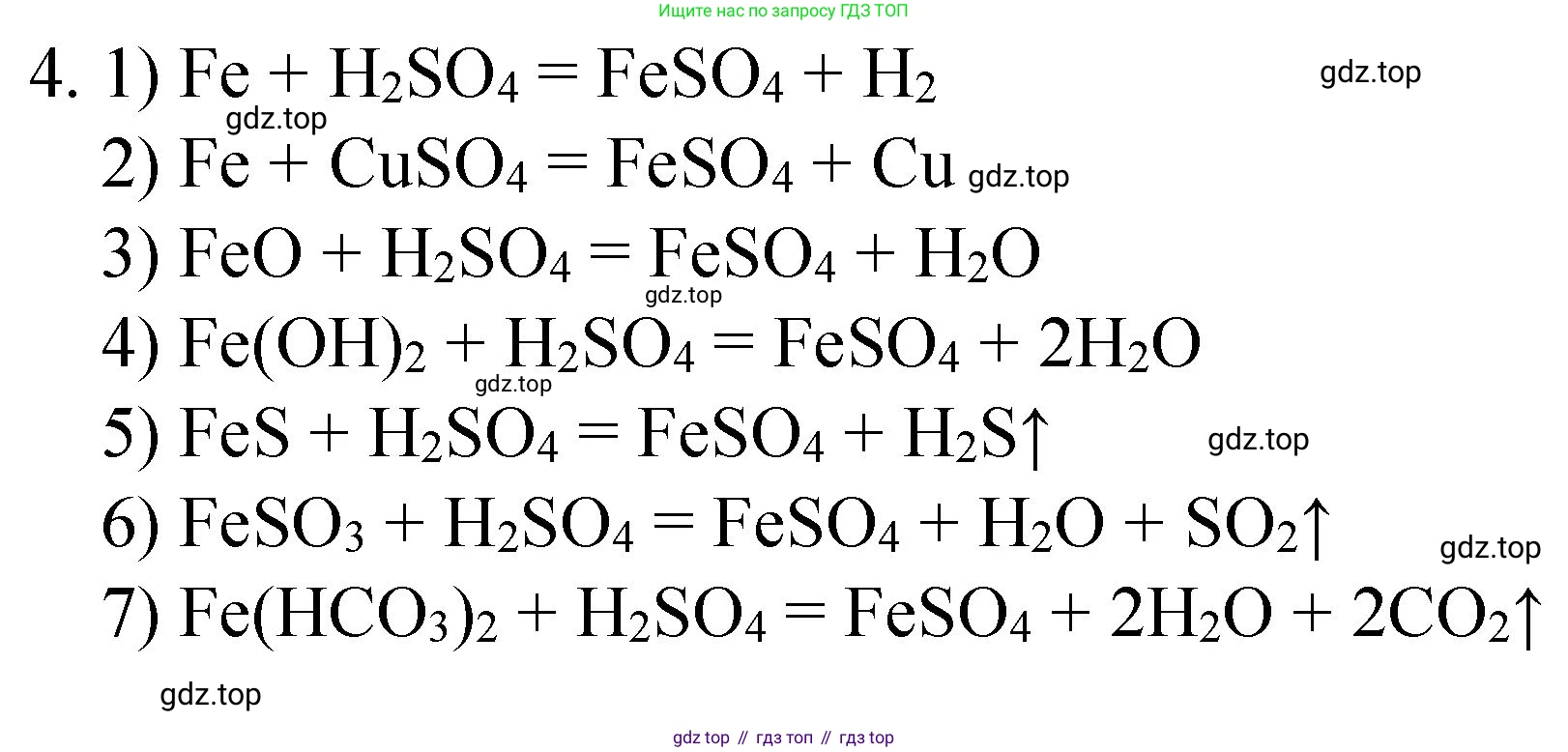
Решение 2. №4 (с. 258)
Сульфат железа(II) ($FeSO_4$) можно получить несколькими способами, которые можно сгруппировать по типу исходных реагентов.
1. Взаимодействие железа с разбавленной серной кислотой
Этот способ основан на реакции замещения, в которой железо, как металл, стоящий в ряду активности до водорода, вытесняет его из разбавленной серной кислоты. При использовании концентрированной серной кислоты реакция пойдет по-другому с образованием сульфата железа(III).
Ответ: $Fe + H_2SO_4 \text{(разб.)} \rightarrow FeSO_4 + H_2 \uparrow$
2. Взаимодействие железа с солью менее активного металла
Железо способно вытеснять менее активные металлы (например, медь) из растворов их солей. В реакции с сульфатом меди(II) образуется сульфат железа(II) и металлическая медь.
Ответ: $Fe + CuSO_4 \rightarrow FeSO_4 + Cu \downarrow$
3. Взаимодействие оксида железа(II) с серной кислотой
Оксид железа(II) ($FeO$) является основным оксидом и вступает в реакцию нейтрализации с серной кислотой, образуя соль и воду.
Ответ: $FeO + H_2SO_4 \rightarrow FeSO_4 + H_2O$
4. Взаимодействие гидроксида железа(II) с серной кислотой
Гидроксид железа(II) ($Fe(OH)_2$), будучи основанием (хоть и нерастворимым), реагирует с серной кислотой в реакции нейтрализации, в результате которой образуется соль и вода.
Ответ: $Fe(OH)_2 + H_2SO_4 \rightarrow FeSO_4 + 2H_2O$
5. Взаимодействие некоторых солей железа(II) с серной кислотой
Сульфат железа(II) можно получить по реакции обмена между другой солью железа(II) и серной кислотой, если в результате реакции образуется газ или осадок. Например, при реакции с карбонатом или сульфидом железа(II) выделяются газы ($CO_2$ или $H_2S$).
Ответ: $FeCO_3 + H_2SO_4 \rightarrow FeSO_4 + H_2O + CO_2 \uparrow$
Ответ: $FeS + H_2SO_4 \rightarrow FeSO_4 + H_2S \uparrow$
6. Реакция обмена между солями
Этот способ возможен, если один из продуктов реакции выпадает в осадок. Например, при реакции растворимого хлорида железа(II) с сульфатом серебра образуется нерастворимый осадок хлорида серебра, что смещает равновесие в сторону образования продуктов.
Ответ: $FeCl_2 + Ag_2SO_4 \rightarrow FeSO_4 + 2AgCl \downarrow$
7. Восстановление сульфата железа(III)
Сульфат железа(II) можно получить путем восстановления сульфата железа(III) ($Fe_2(SO_4)_3$). В качестве восстановителя можно использовать металлическое железо (реакция сопропорционирования) или другие восстановители, например, диоксид серы.
Ответ: $Fe_2(SO_4)_3 + Fe \rightarrow 3FeSO_4$
Ответ: $Fe_2(SO_4)_3 + SO_2 + 2H_2O \rightarrow 2FeSO_4 + 2H_2SO_4$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 4 расположенного на странице 258 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 258), автора: Габриелян (Олег Саргисович), ФГОС (старый) учебного пособия издательства Просвещение.















