Номер 6-13, страница 77 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2026
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 6. Строение атома. Периодический закон и периодическая система Д. И. Менделеева в свете электронной теории. 6.2. Электронная конфигурация атомов - номер 6-13, страница 77.
№6-13 (с. 77)
Условие. №6-13 (с. 77)
скриншот условия

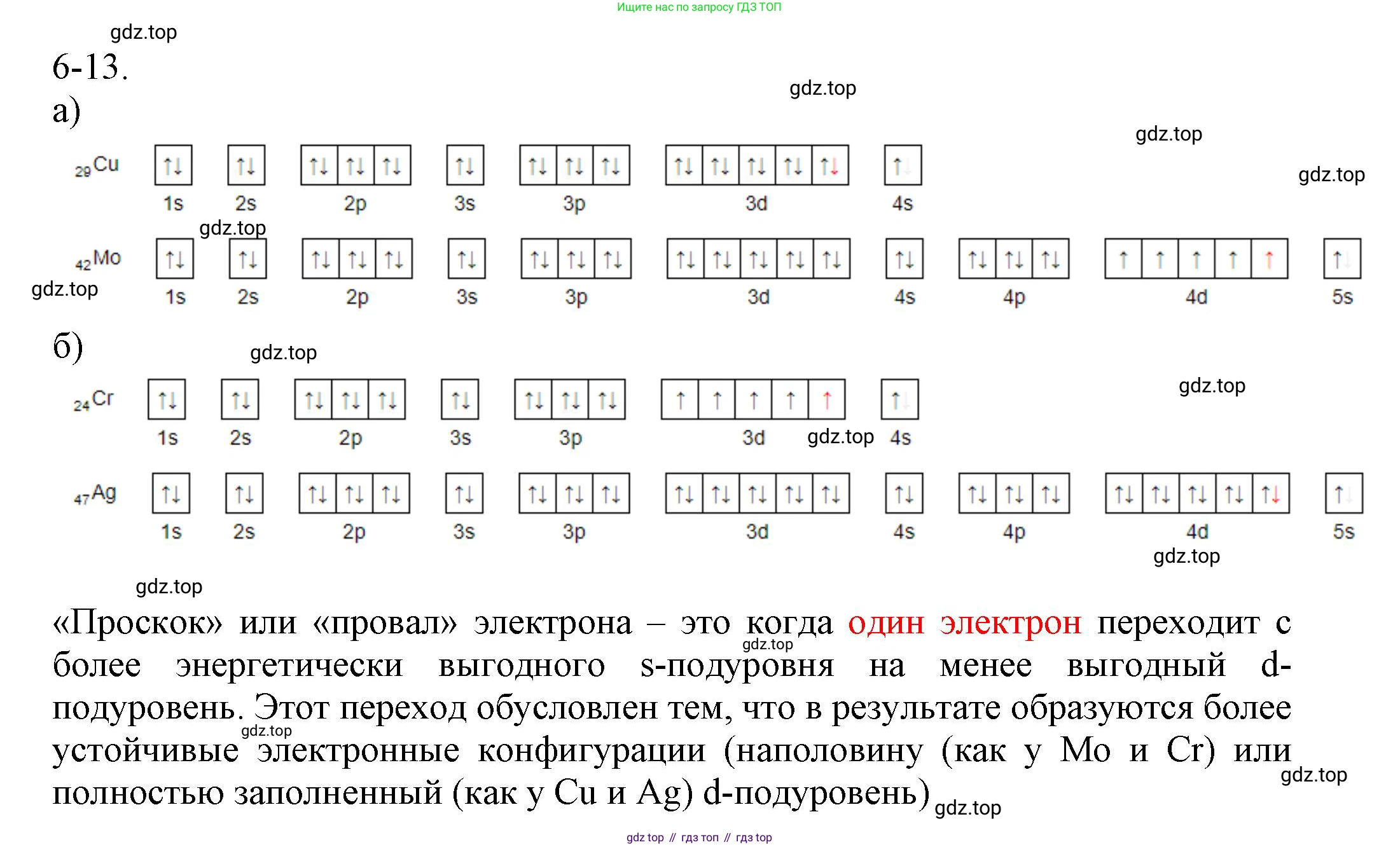
6-13. Вопреки ожиданиям, в атомах некоторых элементов на внешнем энергетическом уровне не $s^2$, а $s^1$-электрон (Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au). Здесь имеет место так называемый «провал», или «проскок», электрона. Изобразите схемы строения атомов:
а) меди и молибдена;
б) хрома и серебра.
Попробуйте объяснить, в чем заключается сущность «провала» электрона.
Решение. №6-13 (с. 77)
Решение 2. №6-13 (с. 77)
Так называемый «провал» или «проскок» электрона — это явление, при котором электронная конфигурация атома отклоняется от ожидаемой, предсказанной правилом Клечковского (принципом наименьшей энергии). Этот эффект наблюдается у некоторых d-элементов и заключается в переходе одного электрона с внешнего $ns$-подуровня на предвнешний $(n-1)d$-подуровень. Причиной является стремление атома к более устойчивому энергетическому состоянию, которое достигается при полном ($d^{10}$) или наполовину ($d^5$) заполнении $d$-подуровня.
а) Схемы строения атомов меди и молибденаМедь (Cu)
Порядковый номер Z = 29. Атом меди находится в 4-м периоде. Ожидаемая электронная конфигурация валентных электронов: $...3d^9 4s^2$. Однако для достижения более стабильного состояния с полностью заполненным $3d$-подуровнем один электрон «проваливается» с $4s$- на $3d$-орбиталь.
Реальная электронная формула: $1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^1$.
Электронно-графическая схема валентных и предвалентных подуровней:
Cu (...$3d^{10}4s^1$)
$4s$ [ ↑ ]
$3d$ [↑↓][↑↓][↑↓][↑↓][↑↓]
Молибден (Mo)
Порядковый номер Z = 42. Атом молибдена находится в 5-м периоде. Ожидаемая электронная конфигурация: $[Kr] 4d^4 5s^2$. Переход электрона с $5s$- на $4d$-подуровень приводит к образованию более устойчивой наполовину заполненной конфигурации $4d^5$.
Реальная электронная формула: $[Kr] 4d^5 5s^1$.
Электронно-графическая схема валентных и предвалентных подуровней:
Mo (...$4d^5 5s^1$)
$5s$ [ ↑ ]
$4d$ [ ↑ ][ ↑ ][ ↑ ][ ↑ ][ ↑ ]
Ответ: Для атома меди (Cu) характерен переход $4s \rightarrow 3d$ с образованием устойчивой конфигурации $3d^{10}4s^1$. Для атома молибдена (Mo) характерен переход $5s \rightarrow 4d$ с образованием устойчивой конфигурации $4d^5 5s^1$.
б) Схемы строения атомов хрома и серебраХром (Cr)
Порядковый номер Z = 24. Атом хрома находится в 4-м периоде. Ожидаемая конфигурация $...3d^4 4s^2$ менее стабильна, чем конфигурация с наполовину заполненным $3d$-подуровнем ($d^5$), которая достигается за счет «провала» электрона.
Реальная электронная формула: $1s^2 2s^2 2p^6 3s^2 3p^6 3d^5 4s^1$.
Электронно-графическая схема валентных и предвалентных подуровней:
Cr (...$3d^5 4s^1$)
$4s$ [ ↑ ]
$3d$ [ ↑ ][ ↑ ][ ↑ ][ ↑ ][ ↑ ]
Серебро (Ag)
Порядковый номер Z = 47. Атом серебра находится в 5-м периоде. Аналогично меди, для достижения более стабильной конфигурации с полностью заполненным $4d$-подуровнем ($d^{10}$) один электрон переходит с $5s$- на $4d$-подуровень.
Реальная электронная формула: $[Kr] 4d^{10} 5s^1$.
Электронно-графическая схема валентных и предвалентных подуровней:
Ag (...$4d^{10} 5s^1$)
$5s$ [ ↑ ]
$4d$ [↑↓][↑↓][↑↓][↑↓][↑↓]
Ответ: У атома хрома (Cr) происходит «провал» электрона с образованием наполовину заполненной конфигурации $3d^5 4s^1$. У атома серебра (Ag) «провал» приводит к полностью заполненной конфигурации $4d^{10} 5s^1$.
Сущность «провала» электронаСущность «провала» электрона заключается в стремлении атома к достижению наиболее энергетически выгодного (стабильного) состояния. Особой устойчивостью обладают две конфигурации d-подуровня:
- Наполовину заполненный подуровень ($d^5$): В этой конфигурации (например, у Cr, Mo) на каждой из пяти d-орбиталей находится по одному электрону с параллельными спинами. Такое симметричное распределение и максимальное число параллельных спинов приводят к увеличению так называемой обменной энергии, что стабилизирует атом.
- Полностью заполненный подуровень ($d^{10}$): Эта конфигурация (например, у Cu, Ag, Au) создает сферически симметричное и стабильное электронное облако, подобное электронным оболочкам инертных газов.
У переходных металлов энергетические уровни внешнего $ns$-подуровня и предвнешнего $(n-1)d$-подуровня очень близки. Поэтому энергетические затраты на "переброс" электрона с $ns$ на $(n-1)d$ оказываются меньше, чем выигрыш в энергии, получаемый от создания более стабильной $d^5$ или $d^{10}$ конфигурации.
Ответ: Сущность «провала» электрона — это самопроизвольный переход электрона с внешнего $s$-подуровня на предвнешний $d$-подуровень для создания более устойчивой электронной конфигурации с наполовину ($d^5$) или полностью ($d^{10}$) заполненным $d$-подуровнем, что является энергетически более выгодным для атома.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 6-13 расположенного на странице 77 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6-13 (с. 77), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.
















