Номер 6-10, страница 77 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2025
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 6. Строение атома. Периодический закон и периодическая система Д. И. Менделеева в свете электронной теории. 6.2. Электронная конфигурация атомов - номер 6-10, страница 77.
№6-10 (с. 77)
Условие. №6-10 (с. 77)
скриншот условия

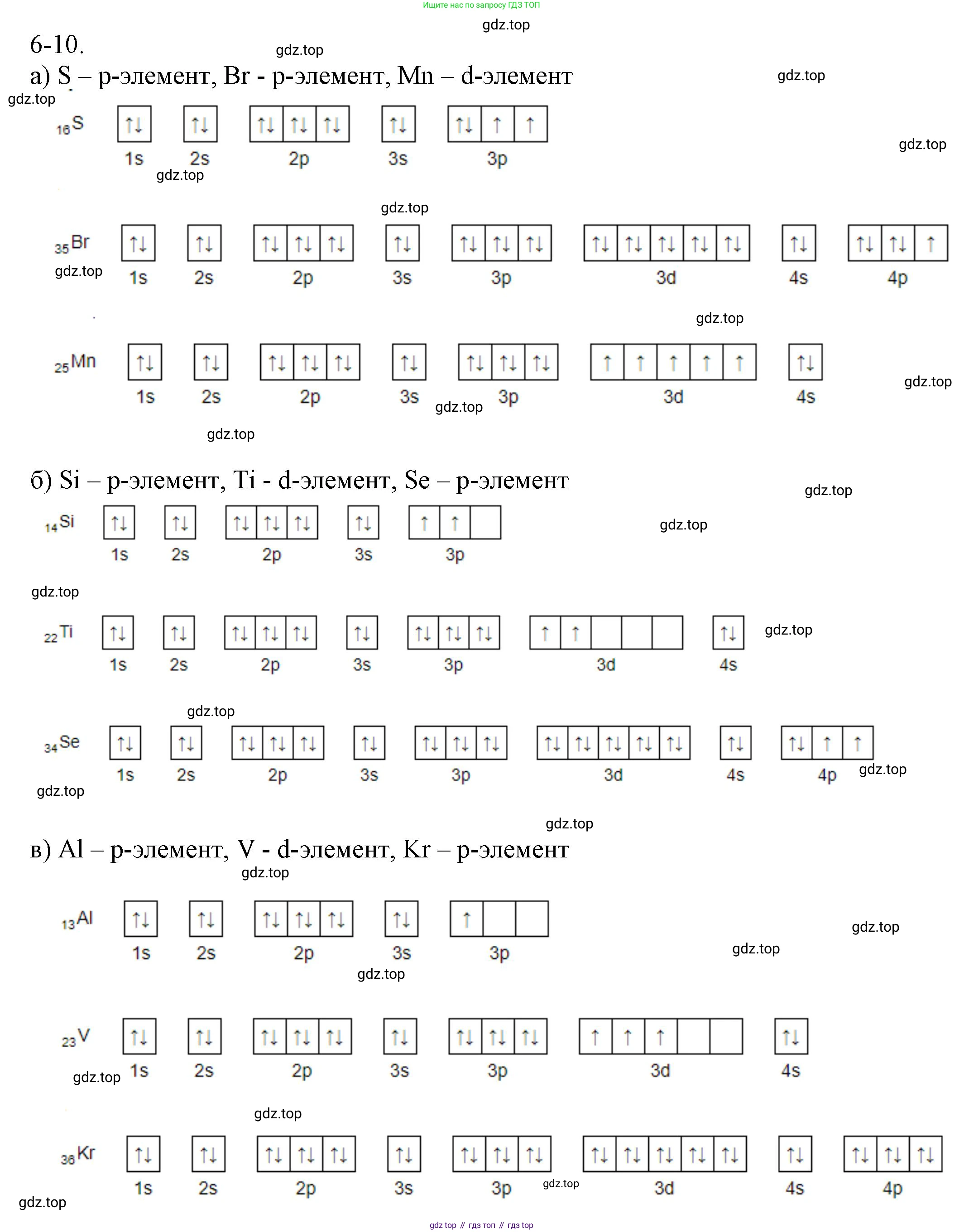
6-10. Изобразите электронные конфигурации атомов, укажите тип (s-, p-, d-) элементов:
а) сера
бром
марганец
б) кремний
титан
селен
в) алюминий
ванадий
криптон
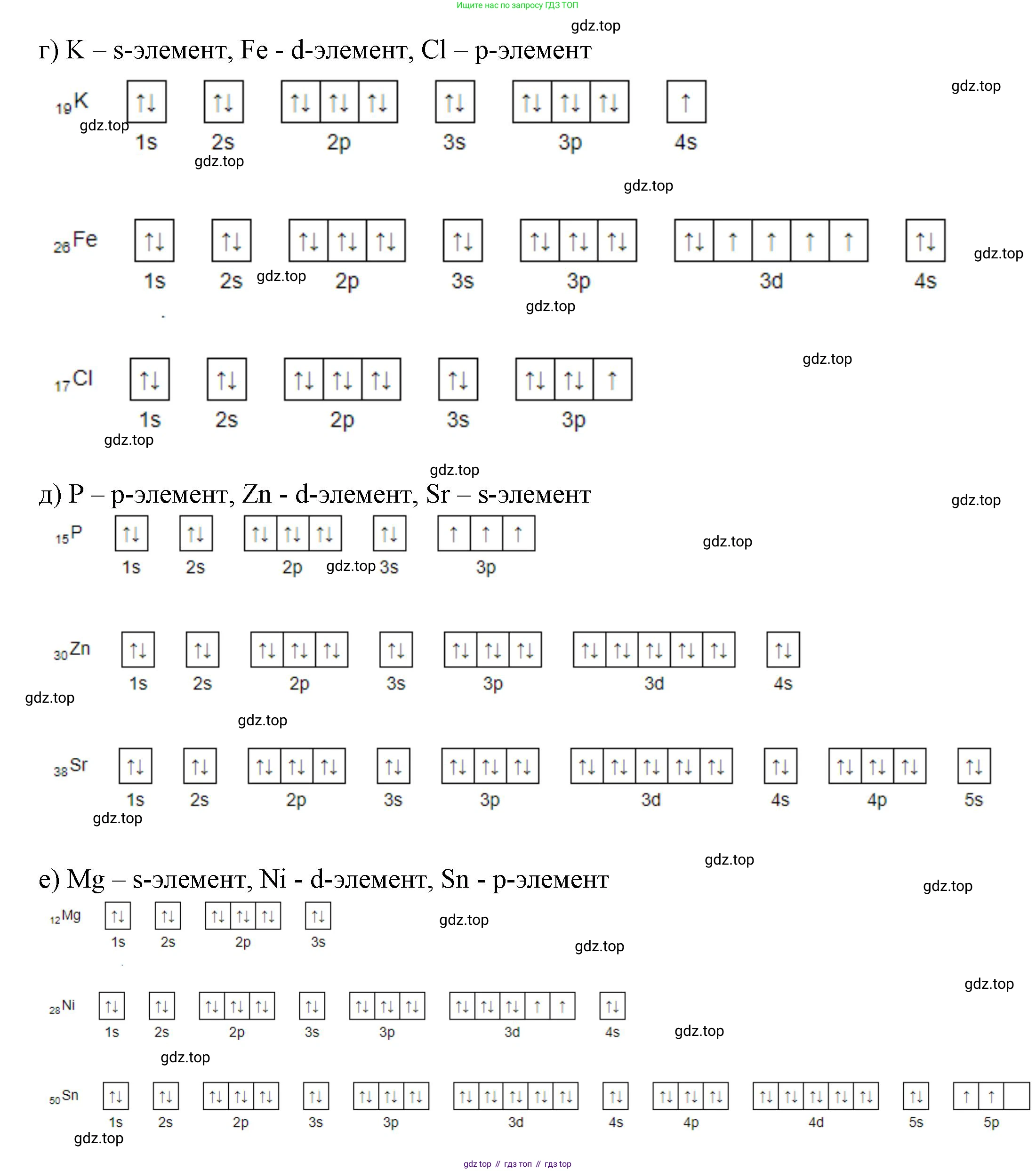
г) калий
железо
хлор
д) фосфор
цинк
стронций
е) магний
никель
олово
Решение. №6-10 (с. 77)
Решение 2. №6-10 (с. 77)
а) Решение
Сера (S). Порядковый номер в периодической системе — 16. Атом серы содержит 16 электронов. Электронная конфигурация атома серы: $1s^22s^22p^63s^23p^4$. Последним у атома серы заполняется p-подуровень, следовательно, сера является p-элементом.
Бром (Br). Порядковый номер — 35. Атом брома содержит 35 электронов. Электронная конфигурация: $1s^22s^22p^63s^23p^64s^23d^{10}4p^5$. Последним у атома брома заполняется p-подуровень, следовательно, бром является p-элементом.
Марганец (Mn). Порядковый номер — 25. Атом марганца содержит 25 электронов. Электронная конфигурация: $1s^22s^22p^63s^23p^64s^23d^5$. Последним у атома марганца заполняется d-подуровень, следовательно, марганец является d-элементом.
Ответ:Сера (S): $1s^22s^22p^63s^23p^4$, p-элемент; Бром (Br): $1s^22s^22p^63s^23p^64s^23d^{10}4p^5$, p-элемент; Марганец (Mn): $1s^22s^22p^63s^23p^64s^23d^5$, d-элемент.
б) Решение
Кремний (Si). Порядковый номер — 14. Атом кремния содержит 14 электронов. Электронная конфигурация: $1s^22s^22p^63s^23p^2$. Последним у атома кремния заполняется p-подуровень, следовательно, кремний является p-элементом.
Титан (Ti). Порядковый номер — 22. Атом титана содержит 22 электрона. Электронная конфигурация: $1s^22s^22p^63s^23p^64s^23d^2$. Последним у атома титана заполняется d-подуровень, следовательно, титан является d-элементом.
Селен (Se). Порядковый номер — 34. Атом селена содержит 34 электрона. Электронная конфигурация: $1s^22s^22p^63s^23p^64s^23d^{10}4p^4$. Последним у атома селена заполняется p-подуровень, следовательно, селен является p-элементом.
Ответ:Кремний (Si): $1s^22s^22p^63s^23p^2$, p-элемент; Титан (Ti): $1s^22s^22p^63s^23p^64s^23d^2$, d-элемент; Селен (Se): $1s^22s^22p^63s^23p^64s^23d^{10}4p^4$, p-элемент.
в) Решение
Алюминий (Al). Порядковый номер — 13. Атом алюминия содержит 13 электронов. Электронная конфигурация: $1s^22s^22p^63s^23p^1$. Последним у атома алюминия заполняется p-подуровень, следовательно, алюминий является p-элементом.
Ванадий (V). Порядковый номер — 23. Атом ванадия содержит 23 электрона. Электронная конфигурация: $1s^22s^22p^63s^23p^64s^23d^3$. Последним у атома ванадия заполняется d-подуровень, следовательно, ванадий является d-элементом.
Криптон (Kr). Порядковый номер — 36. Атом криптона содержит 36 электронов. Электронная конфигурация: $1s^22s^22p^63s^23p^64s^23d^{10}4p^6$. Последним у атома криптона заполняется p-подуровень, следовательно, криптон является p-элементом (благородный газ).
Ответ:Алюминий (Al): $1s^22s^22p^63s^23p^1$, p-элемент; Ванадий (V): $1s^22s^22p^63s^23p^64s^23d^3$, d-элемент; Криптон (Kr): $1s^22s^22p^63s^23p^64s^23d^{10}4p^6$, p-элемент.
г) Решение
Калий (K). Порядковый номер — 19. Атом калия содержит 19 электронов. Электронная конфигурация: $1s^22s^22p^63s^23p^64s^1$. Последним у атома калия заполняется s-подуровень, следовательно, калий является s-элементом.
Железо (Fe). Порядковый номер — 26. Атом железа содержит 26 электронов. Электронная конфигурация: $1s^22s^22p^63s^23p^64s^23d^6$. Последним у атома железа заполняется d-подуровень, следовательно, железо является d-элементом.
Хлор (Cl). Порядковый номер — 17. Атом хлора содержит 17 электронов. Электронная конфигурация: $1s^22s^22p^63s^23p^5$. Последним у атома хлора заполняется p-подуровень, следовательно, хлор является p-элементом.
Ответ:Калий (K): $1s^22s^22p^63s^23p^64s^1$, s-элемент; Железо (Fe): $1s^22s^22p^63s^23p^64s^23d^6$, d-элемент; Хлор (Cl): $1s^22s^22p^63s^23p^5$, p-элемент.
д) Решение
Фосфор (P). Порядковый номер — 15. Атом фосфора содержит 15 электронов. Электронная конфигурация: $1s^22s^22p^63s^23p^3$. Последним у атома фосфора заполняется p-подуровень, следовательно, фосфор является p-элементом.
Цинк (Zn). Порядковый номер — 30. Атом цинка содержит 30 электронов. Электронная конфигурация: $1s^22s^22p^63s^23p^64s^23d^{10}$. Последним у атома цинка заполняется d-подуровень, следовательно, цинк является d-элементом.
Стронций (Sr). Порядковый номер — 38. Атом стронция содержит 38 электронов. Электронная конфигурация: $1s^22s^22p^63s^23p^64s^23d^{10}4p^65s^2$. Последним у атома стронция заполняется s-подуровень, следовательно, стронций является s-элементом.
Ответ:Фосфор (P): $1s^22s^22p^63s^23p^3$, p-элемент; Цинк (Zn): $1s^22s^22p^63s^23p^64s^23d^{10}$, d-элемент; Стронций (Sr): $1s^22s^22p^63s^23p^64s^23d^{10}4p^65s^2$, s-элемент.
е) Решение
Магний (Mg). Порядковый номер — 12. Атом магния содержит 12 электронов. Электронная конфигурация: $1s^22s^22p^63s^2$. Последним у атома магния заполняется s-подуровень, следовательно, магний является s-элементом.
Никель (Ni). Порядковый номер — 28. Атом никеля содержит 28 электронов. Электронная конфигурация: $1s^22s^22p^63s^23p^64s^23d^8$. Последним у атома никеля заполняется d-подуровень, следовательно, никель является d-элементом.
Олово (Sn). Порядковый номер — 50. Атом олова содержит 50 электронов. Электронная конфигурация: $1s^22s^22p^63s^23p^64s^23d^{10}4p^65s^24d^{10}5p^2$. Последним у атома олова заполняется p-подуровень, следовательно, олово является p-элементом.
Ответ:Магний (Mg): $1s^22s^22p^63s^2$, s-элемент; Никель (Ni): $1s^22s^22p^63s^23p^64s^23d^8$, d-элемент; Олово (Sn): $1s^22s^22p^63s^23p^64s^23d^{10}4p^65s^24d^{10}5p^2$, p-элемент.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 6-10 расположенного на странице 77 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6-10 (с. 77), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.















