Номер 4, страница 41 - гдз по химии 9 класс учебник Габриелян, Остроумов

Авторы: Габриелян О. С., Остроумов И. Г., Сладков С. А.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-110655-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава II. Химические реакции в растворах. §6. Химические свойства кислот как электролитов. Примените свои знания - номер 4, страница 41.
№4 (с. 41)
Условие. №4 (с. 41)
скриншот условия

4. Запишите уравнения реакций (в молекулярной и ионной формах), характеризующих свойства:
а) серной кислоты;
б) соляной кислоты.
Решение. №4 (с. 41)

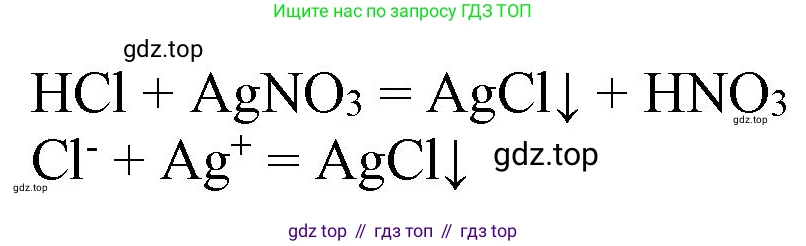
Решение 2. №4 (с. 41)
Решение
Для характеристики свойств кислот запишем их типичные химические реакции в молекулярной и ионной формах. Общими свойствами кислот являются реакции с металлами, стоящими в ряду активности до водорода, с основными и амфотерными оксидами, с основаниями и амфотерными гидроксидами, а также с солями более слабых или летучих кислот.
а) серной кислоты
Серная кислота ($H_2SO_4$) — сильная двухосновная кислота. Рассмотрим свойства ее разбавленного раствора.
1. Взаимодействие с активными металлами (на примере цинка):
Молекулярное уравнение:
$H_2SO_4 + Zn \rightarrow ZnSO_4 + H_2 \uparrow$
Полное ионное уравнение:
$2H^+ + SO_4^{2-} + Zn^0 \rightarrow Zn^{2+} + SO_4^{2-} + H_2^0 \uparrow$
Сокращенное ионное уравнение:
$2H^+ + Zn \rightarrow Zn^{2+} + H_2 \uparrow$
2. Взаимодействие с основными оксидами (на примере оксида меди(II)):
Молекулярное уравнение:
$H_2SO_4 + CuO \rightarrow CuSO_4 + H_2O$
Полное ионное уравнение (оксид меди нерастворим):
$2H^+ + SO_4^{2-} + CuO \rightarrow Cu^{2+} + SO_4^{2-} + H_2O$
Сокращенное ионное уравнение:
$2H^+ + CuO \rightarrow Cu^{2+} + H_2O$
3. Взаимодействие с основаниями (реакция нейтрализации на примере гидроксида натрия):
Молекулярное уравнение:
$H_2SO_4 + 2NaOH \rightarrow Na_2SO_4 + 2H_2O$
Полное ионное уравнение:
$2H^+ + SO_4^{2-} + 2Na^+ + 2OH^- \rightarrow 2Na^+ + SO_4^{2-} + 2H_2O$
Сокращенное ионное уравнение:
$H^+ + OH^- \rightarrow H_2O$
4. Взаимодействие с солями (качественная реакция на сульфат-ион с хлоридом бария):
Молекулярное уравнение:
$H_2SO_4 + BaCl_2 \rightarrow BaSO_4 \downarrow + 2HCl$
Полное ионное уравнение:
$2H^+ + SO_4^{2-} + Ba^{2+} + 2Cl^- \rightarrow BaSO_4 \downarrow + 2H^+ + 2Cl^-$
Сокращенное ионное уравнение:
$SO_4^{2-} + Ba^{2+} \rightarrow BaSO_4 \downarrow$
Ответ:
Уравнения реакций, характеризующие свойства серной кислоты:
$H_2SO_4 + Zn \rightarrow ZnSO_4 + H_2 \uparrow$
$H_2SO_4 + CuO \rightarrow CuSO_4 + H_2O$
$H_2SO_4 + 2NaOH \rightarrow Na_2SO_4 + 2H_2O$
$H_2SO_4 + BaCl_2 \rightarrow BaSO_4 \downarrow + 2HCl$
б) соляной кислоты
Соляная кислота ($HCl$) — сильная одноосновная кислота.
1. Взаимодействие с активными металлами (на примере магния):
Молекулярное уравнение:
$2HCl + Mg \rightarrow MgCl_2 + H_2 \uparrow$
Полное ионное уравнение:
$2H^+ + 2Cl^- + Mg^0 \rightarrow Mg^{2+} + 2Cl^- + H_2^0 \uparrow$
Сокращенное ионное уравнение:
$2H^+ + Mg \rightarrow Mg^{2+} + H_2 \uparrow$
2. Взаимодействие с нерастворимыми основаниями (на примере гидроксида алюминия):
Молекулярное уравнение:
$3HCl + Al(OH)_3 \rightarrow AlCl_3 + 3H_2O$
Полное ионное уравнение (гидроксид алюминия нерастворим):
$3H^+ + 3Cl^- + Al(OH)_3 \downarrow \rightarrow Al^{3+} + 3Cl^- + 3H_2O$
Сокращенное ионное уравнение:
$3H^+ + Al(OH)_3 \downarrow \rightarrow Al^{3+} + 3H_2O$
3. Взаимодействие с основаниями (реакция нейтрализации на примере гидроксида калия):
Молекулярное уравнение:
$HCl + KOH \rightarrow KCl + H_2O$
Полное ионное уравнение:
$H^+ + Cl^- + K^+ + OH^- \rightarrow K^+ + Cl^- + H_2O$
Сокращенное ионное уравнение:
$H^+ + OH^- \rightarrow H_2O$
4. Взаимодействие с солями слабых кислот (на примере карбоната натрия):
Молекулярное уравнение:
$2HCl + Na_2CO_3 \rightarrow 2NaCl + H_2O + CO_2 \uparrow$
Полное ионное уравнение:
$2H^+ + 2Cl^- + 2Na^+ + CO_3^{2-} \rightarrow 2Na^+ + 2Cl^- + H_2O + CO_2 \uparrow$
Сокращенное ионное уравнение:
$2H^+ + CO_3^{2-} \rightarrow H_2O + CO_2 \uparrow$
Ответ:
Уравнения реакций, характеризующие свойства соляной кислоты:
$2HCl + Mg \rightarrow MgCl_2 + H_2 \uparrow$
$3HCl + Al(OH)_3 \rightarrow AlCl_3 + 3H_2O$
$HCl + KOH \rightarrow KCl + H_2O$
$2HCl + Na_2CO_3 \rightarrow 2NaCl + H_2O + CO_2 \uparrow$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 4 расположенного на странице 41 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 41), авторов: Габриелян (Олег Саргисович), Остроумов (Игорь Геннадьевич), Сладков (Сергей Анатольевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.














