Номер 30, страница 105 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
10. Металлы. Упражнения и задачи для самостоятельного решения - номер 30, страница 105.
№30 (с. 105)
Условие. №30 (с. 105)
скриншот условия

30. В четырёх пробирках находятся водные растворы сульфида, сульфита, сульфата и силиката натрия. Как с помощью одного реактива можно распознать содержимое каждой пробирки? Ответ подтвердите уравнениями реакций.
Решение. №30 (с. 105)
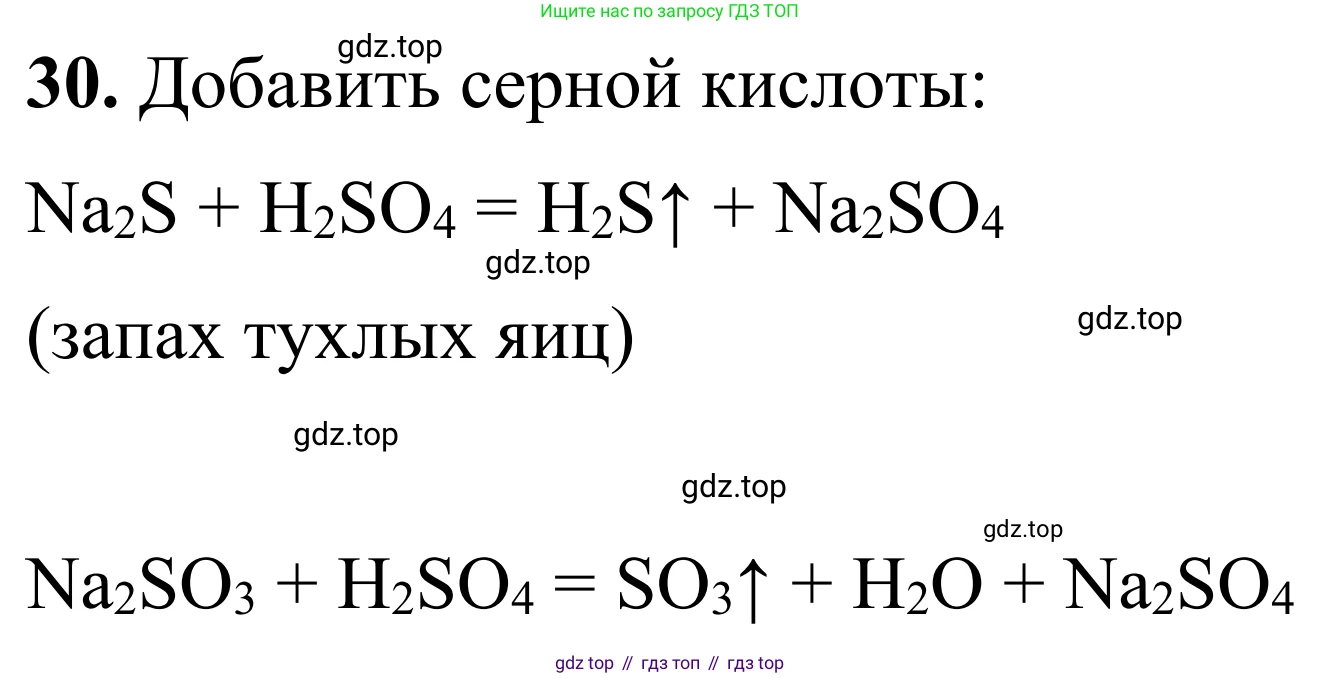

Решение 2. №30 (с. 105)
Для распознавания содержимого каждой из четырёх пробирок можно использовать один реактив — раствор сильной кислоты, например, соляной кислоты ($HCl$) или серной кислоты ($H_2SO_4$). При добавлении раствора кислоты в каждую из пробирок будут наблюдаться различные эффекты, позволяющие однозначно идентифицировать каждое вещество.
Решение
В качестве универсального реактива выберем раствор соляной кислоты ($HCl$). Добавим по несколько капель раствора $HCl$ в каждую из четырёх пробирок и пронаблюдаем за результатами.
1. Пробирка с сульфидом натрия ($Na_2S$):
При добавлении кислоты произойдёт выделение бесцветного газа с резким неприятным запахом тухлых яиц — сероводорода ($H_2S$).
Уравнение реакции:
$Na_2S + 2HCl \rightarrow 2NaCl + H_2S\uparrow$
2. Пробирка с сульфитом натрия ($Na_2SO_3$):
При добавлении кислоты произойдёт выделение бесцветного газа с резким удушливым запахом (запах зажжённой спички) — диоксида серы ($SO_2$).
Уравнение реакции:
$Na_2SO_3 + 2HCl \rightarrow 2NaCl + SO_2\uparrow + H_2O$
3. Пробирка с силикатом натрия ($Na_2SiO_3$):
При добавлении кислоты произойдёт образование белого студенистого (гелеобразного) осадка — кремниевой кислоты ($H_2SiO_3$), нерастворимой в воде.
Уравнение реакции:
$Na_2SiO_3 + 2HCl \rightarrow 2NaCl + H_2SiO_3\downarrow$
4. Пробирка с сульфатом натрия ($Na_2SO_4$):
Видимых изменений не произойдёт. Сульфат натрия — это соль, образованная сильным основанием ($NaOH$) и сильной кислотой ($H_2SO_4$), поэтому она не вступает в реакцию обмена с соляной кислотой.
Таким образом, по четырём различным наблюдаемым эффектам (выделение газа с запахом тухлых яиц, выделение газа с резким удушливым запахом, образование студенистого осадка и отсутствие реакции) можно однозначно определить содержимое каждой пробирки.
Ответ: для распознавания растворов сульфида, сульфита, сульфата и силиката натрия следует использовать раствор сильной кислоты (например, соляной, $HCl$). Признаки реакций: с сульфидом натрия – выделение газа $H_2S$ с запахом тухлых яиц; с сульфитом натрия – выделение газа $SO_2$ с резким запахом; с силикатом натрия – выпадение белого студенистого осадка $H_2SiO_3$; с сульфатом натрия – видимые изменения отсутствуют.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 30 расположенного на странице 105 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №30 (с. 105), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















