Номер 34, страница 105 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2025
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
10. Металлы. Упражнения и задачи для самостоятельного решения - номер 34, страница 105.
№34 (с. 105)
Условие. №34 (с. 105)
скриншот условия


34. Составьте уравнения химических реакций, соответствующих следующим превращениям:
a) карбонат кальция ($CaCO_3$) → оксид кальция ($CaO$) → гидроксид кальция ($Ca(OH)_2$) → карбонат кальция ($CaCO_3$) → нитрат кальция ($Ca(NO_3)_2$)
б) магний ($Mg$) → сульфат магния ($MgSO_4$) → нитрат магния ($Mg(NO_3)_2$) → оксид магния ($MgO$) → ацетат магния ($Mg(CH_3COO)_2$)
в) хлорид кальция ($CaCl_2$) → сульфат кальция ($CaSO_4$) → сульфид кальция ($CaS$) → сульфат кальция ($CaSO_4$) → гидроксид кальция ($Ca(OH)_2$) → оксид кальция ($CaO$) → гидрокарбонат кальция ($Ca(HCO_3)_2$)
г) магний ($Mg$) → оксид магния ($MgO$) → гидроксид магния ($Mg(OH)_2$) → хлорид магния ($MgCl_2$) → гидроксокарбонат магния ($MgCO_3 \cdot Mg(OH)_2$) → сульфат магния ($MgSO_4$) → гидроксид магния ($Mg(OH)_2$)
д) сульфид магния ($MgS$) → оксид магния ($MgO$) → X → гидроксид магния ($Mg(OH)_2$) → Y → нитрат магния ($Mg(NO_3)_2$)
е) кальций ($Ca$) → гидроксид кальция ($Ca(OH)_2$) → карбонат кальция ($CaCO_3$) → оксид кальция ($CaO$) → карбид кальция ($CaC_2$) → гидроксид кальция ($Ca(OH)_2$) → гидрокарбонат кальция ($Ca(HCO_3)_2$)
Решение. №34 (с. 105)


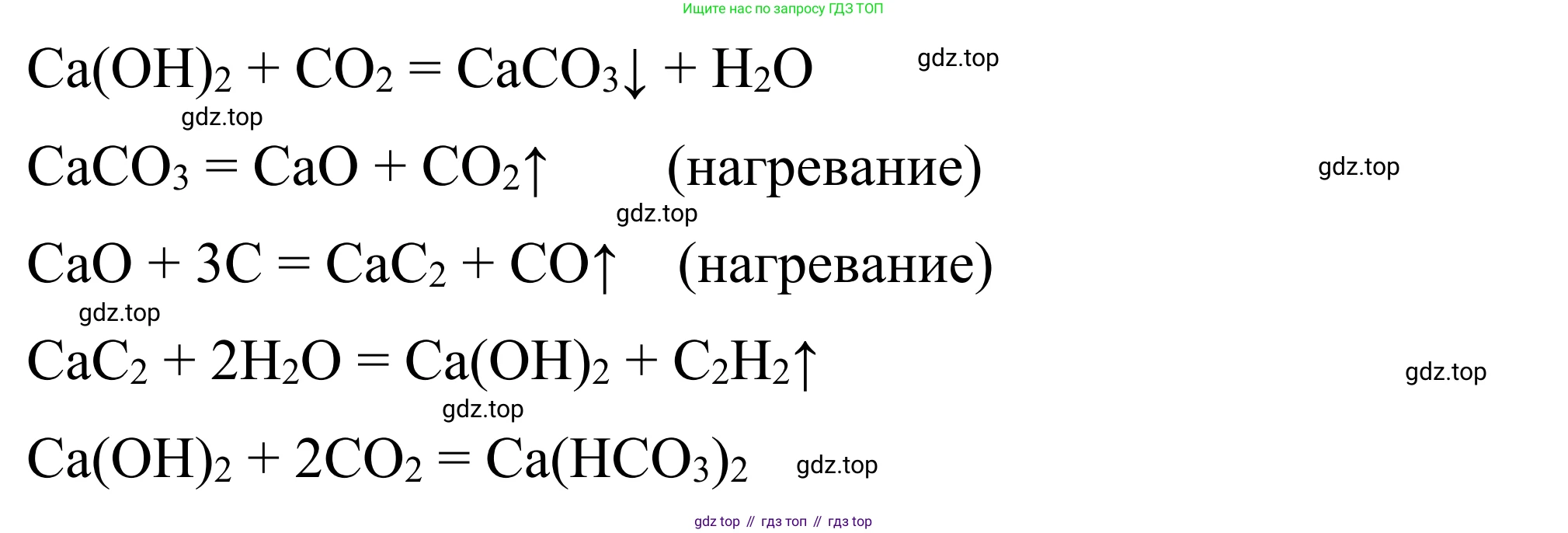
Решение 2. №34 (с. 105)
а) Решение:
1. Получение оксида кальция из карбоната кальция осуществляется путем термического разложения (прокаливания) известняка:
$CaCO_3 \xrightarrow{t^\circ} CaO + CO_2\uparrow$
2. Оксид кальция (негашеная известь) реагирует с водой, образуя гидроксид кальция (гашеную известь):
$CaO + H_2O \rightarrow Ca(OH)_2$
3. Для получения карбоната кальция из гидроксида кальция через раствор пропускают углекислый газ:
$Ca(OH)_2 + CO_2 \rightarrow CaCO_3\downarrow + H_2O$
4. Карбонат кальция реагирует с азотной кислотой с образованием растворимой соли нитрата кальция:
$CaCO_3 + 2HNO_3 \rightarrow Ca(NO_3)_2 + H_2O + CO_2\uparrow$
Ответ:
$CaCO_3 \xrightarrow{t^\circ} CaO + CO_2\uparrow$
$CaO + H_2O \rightarrow Ca(OH)_2$
$Ca(OH)_2 + CO_2 \rightarrow CaCO_3\downarrow + H_2O$
$CaCO_3 + 2HNO_3 \rightarrow Ca(NO_3)_2 + H_2O + CO_2\uparrow$
б) Решение:
1. Магний, как активный металл, реагирует с серной кислотой, образуя сульфат магния и водород:
$Mg + H_2SO_4 \rightarrow MgSO_4 + H_2\uparrow$
2. Для превращения сульфата магния в нитрат магния можно использовать реакцию ионного обмена с растворимой солью бария, например, нитратом бария. Сульфат бария выпадет в осадок:
$MgSO_4 + Ba(NO_3)_2 \rightarrow Mg(NO_3)_2 + BaSO_4\downarrow$
3. Нитрат магния при нагревании разлагается на оксид магния, диоксид азота и кислород:
$2Mg(NO_3)_2 \xrightarrow{t^\circ} 2MgO + 4NO_2\uparrow + O_2\uparrow$
4. Оксид магния, являясь основным оксидом, реагирует с уксусной кислотой, образуя соль ацетат магния:
$MgO + 2CH_3COOH \rightarrow Mg(CH_3COO)_2 + H_2O$
Ответ:
$Mg + H_2SO_4 \rightarrow MgSO_4 + H_2\uparrow$
$MgSO_4 + Ba(NO_3)_2 \rightarrow Mg(NO_3)_2 + BaSO_4\downarrow$
$2Mg(NO_3)_2 \xrightarrow{t^\circ} 2MgO + 4NO_2\uparrow + O_2\uparrow$
$MgO + 2CH_3COOH \rightarrow Mg(CH_3COO)_2 + H_2O$
в) Решение:
1. Хлорид кальция вступает в реакцию обмена с сульфатом натрия с образованием малорастворимого сульфата кальция:
$CaCl_2 + Na_2SO_4 \rightarrow CaSO_4\downarrow + 2NaCl$
2. Сульфат кальция можно восстановить до сульфида кальция углем при высокой температуре:
$CaSO_4 + 4C \xrightarrow{t^\circ} CaS + 4CO\uparrow$
3. Сульфид кальция можно окислить до сульфата кальция с помощью пероксида водорода:
$CaS + 4H_2O_2 \rightarrow CaSO_4 + 4H_2O$
4. Для получения гидроксида кальция из сульфата кальция можно провести реакцию с гидроксидом бария. Образуются два малорастворимых вещества:
$CaSO_4 + Ba(OH)_2 \rightarrow Ca(OH)_2\downarrow + BaSO_4\downarrow$
5. Гидроксид кальция при нагревании разлагается на оксид кальция и воду:
$Ca(OH)_2 \xrightarrow{t^\circ} CaO + H_2O$
6. Оксид кальция в присутствии воды реагирует с избытком углекислого газа, образуя растворимый гидрокарбонат кальция:
$CaO + H_2O + 2CO_2(\text{изб.}) \rightarrow Ca(HCO_3)_2$
Ответ:
$CaCl_2 + Na_2SO_4 \rightarrow CaSO_4\downarrow + 2NaCl$
$CaSO_4 + 4C \xrightarrow{t^\circ} CaS + 4CO\uparrow$
$CaS + 4H_2O_2 \rightarrow CaSO_4 + 4H_2O$
$CaSO_4 + Ba(OH)_2 \rightarrow Ca(OH)_2\downarrow + BaSO_4\downarrow$
$Ca(OH)_2 \xrightarrow{t^\circ} CaO + H_2O$
$CaO + H_2O + 2CO_2(\text{изб.}) \rightarrow Ca(HCO_3)_2$
г) Решение:
1. Магний сгорает в кислороде, образуя оксид магния:
$2Mg + O_2 \xrightarrow{t^\circ} 2MgO$
2. Оксид магния медленно реагирует с водой с образованием нерастворимого гидроксида магния:
$MgO + H_2O \rightarrow Mg(OH)_2\downarrow$
3. Гидроксид магния, как основание, нейтрализуется соляной кислотой с образованием хлорида магния:
$Mg(OH)_2 + 2HCl \rightarrow MgCl_2 + 2H_2O$
4. При реакции хлорида магния с карбонатом натрия в водном растворе образуется осадок основной соли - гидроксокарбоната магния:
$2MgCl_2 + 2Na_2CO_3 + H_2O \rightarrow (MgOH)_2CO_3\downarrow + 4NaCl + CO_2\uparrow$
5. Гидроксокарбонат магния реагирует с серной кислотой с образованием сульфата магния:
$(MgOH)_2CO_3 + 2H_2SO_4 \rightarrow 2MgSO_4 + 3H_2O + CO_2\uparrow$
6. Из раствора сульфата магния можно осадить гидроксид магния действием щелочи, например, гидроксида натрия:
$MgSO_4 + 2NaOH \rightarrow Mg(OH)_2\downarrow + Na_2SO_4$
Ответ:
$2Mg + O_2 \xrightarrow{t^\circ} 2MgO$
$MgO + H_2O \rightarrow Mg(OH)_2\downarrow$
$Mg(OH)_2 + 2HCl \rightarrow MgCl_2 + 2H_2O$
$2MgCl_2 + 2Na_2CO_3 + H_2O \rightarrow (MgOH)_2CO_3\downarrow + 4NaCl + CO_2\uparrow$
$(MgOH)_2CO_3 + 2H_2SO_4 \rightarrow 2MgSO_4 + 3H_2O + CO_2\uparrow$
$MgSO_4 + 2NaOH \rightarrow Mg(OH)_2\downarrow + Na_2SO_4$
д) Решение:
1. Обжиг сульфида магния в токе кислорода приводит к образованию оксида магния и диоксида серы:
$2MgS + 3O_2 \xrightarrow{t^\circ} 2MgO + 2SO_2\uparrow$
2. В переходе $MgO \rightarrow X \rightarrow Mg(OH)_2$ необходимо ввести промежуточное вещество X. Логично предположить, что X - это растворимая соль магния, например, хлорид магния ($MgCl_2$), которую можно получить из оксида, а затем из нее осадить гидроксид. Вещество X - хлорид магния ($MgCl_2$).
$MgO + 2HCl \rightarrow MgCl_2 + H_2O$
$MgCl_2 + 2NaOH \rightarrow Mg(OH)_2\downarrow + 2NaCl$
3. В переходе $Mg(OH)_2 \rightarrow Y \rightarrow Mg(NO_3)_2$ вещество Y - также промежуточный продукт. Гидроксид магния можно термически разложить до оксида магния ($MgO$), который затем легко реагирует с азотной кислотой. Вещество Y - оксид магния ($MgO$).
$Mg(OH)_2 \xrightarrow{t^\circ} MgO + H_2O$
$MgO + 2HNO_3 \rightarrow Mg(NO_3)_2 + H_2O$
Ответ:
Вещество X - хлорид магния ($MgCl_2$), вещество Y - оксид магния ($MgO$).
Уравнения реакций для всей цепочки:
$2MgS + 3O_2 \xrightarrow{t^\circ} 2MgO + 2SO_2\uparrow$
$MgO + 2HCl \rightarrow MgCl_2 + H_2O$
$MgCl_2 + 2NaOH \rightarrow Mg(OH)_2\downarrow + 2NaCl$
$Mg(OH)_2 \xrightarrow{t^\circ} MgO + H_2O$
$MgO + 2HNO_3 \rightarrow Mg(NO_3)_2 + H_2O$
е) Решение:
1. Кальций, как щелочноземельный металл, бурно реагирует с водой с образованием гидроксида кальция и выделением водорода:
$Ca + 2H_2O \rightarrow Ca(OH)_2 + H_2\uparrow$
2. Гидроксид кальция (известковая вода) реагирует с углекислым газом с образованием белого осадка карбоната кальция:
$Ca(OH)_2 + CO_2 \rightarrow CaCO_3\downarrow + H_2O$
3. Карбонат кальция при сильном нагревании разлагается на оксид кальция и углекислый газ:
$CaCO_3 \xrightarrow{t^\circ} CaO + CO_2\uparrow$
4. Карбид кальция получают в промышленности прокаливанием оксида кальция с углем (коксом) в электропечах:
$CaO + 3C \xrightarrow{t^\circ} CaC_2 + CO\uparrow$
5. Карбид кальция легко реагирует с водой (гидролизуется), образуя гидроксид кальция и ацетилен:
$CaC_2 + 2H_2O \rightarrow Ca(OH)_2 + C_2H_2\uparrow$
6. При пропускании избытка углекислого газа через суспензию гидроксида кальция образуется растворимый гидрокарбонат кальция:
$Ca(OH)_2 + 2CO_2(\text{изб.}) \rightarrow Ca(HCO_3)_2$
Ответ:
$Ca + 2H_2O \rightarrow Ca(OH)_2 + H_2\uparrow$
$Ca(OH)_2 + CO_2 \rightarrow CaCO_3\downarrow + H_2O$
$CaCO_3 \xrightarrow{t^\circ} CaO + CO_2\uparrow$
$CaO + 3C \xrightarrow{t^\circ} CaC_2 + CO\uparrow$
$CaC_2 + 2H_2O \rightarrow Ca(OH)_2 + C_2H_2\uparrow$
$Ca(OH)_2 + 2CO_2(\text{изб.}) \rightarrow Ca(HCO_3)_2$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 34 расположенного на странице 105 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №34 (с. 105), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















