Номер 3, страница 91 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 5. Азот и фосфор. Параграф 26. Соли аммония. Подумай, ответь, выполни... - номер 3, страница 91.
№3 (с. 91)
Условие. №3 (с. 91)
скриншот условия

3. Начертите в тетради таблицу. В соответствующих графах запишите молекулярные и ионные уравнения реакций, поясняющих химические свойства указанных солей. Проверьте выполнение задания у соседа по парте.
| Соль | Химические свойства, общие с другими солями | Специфические свойства |
| $NH_4Cl$ | ||
| $(NH_4)_2CO_3$ | ||
| $(NH_4)_2S$ | ||
| $(NH_4)_2SO_4$ |
Решение. №3 (с. 91)
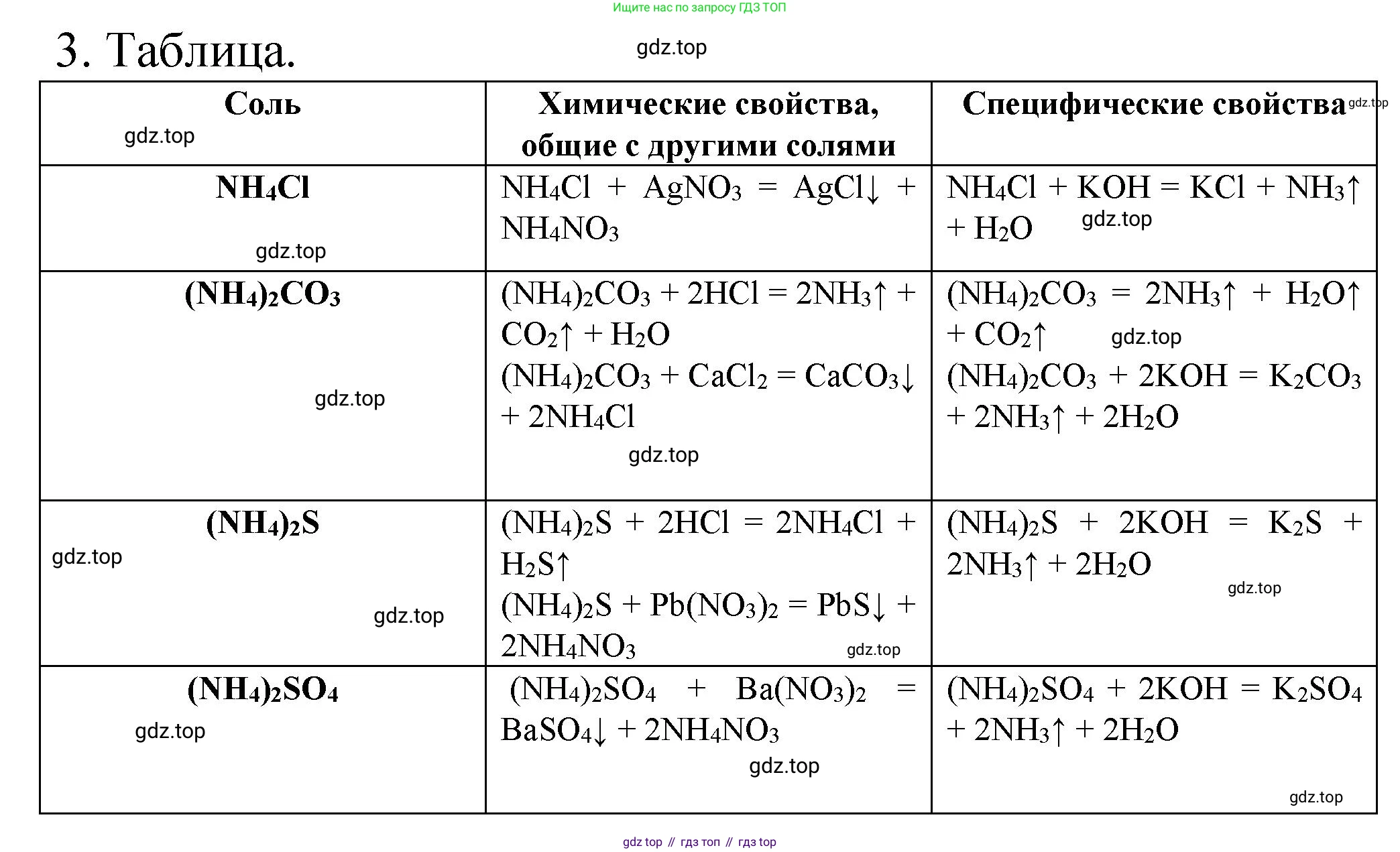
Решение 2. №3 (с. 91)
NH₄Cl (Хлорид аммония)
Химические свойства, общие с другими солями
Взаимодействие с растворимыми солями с образованием осадка. Эта реакция является качественной на хлорид-ионы.
Молекулярное уравнение:
$NH_4Cl + AgNO_3 = AgCl \downarrow + NH_4NO_3$
Полное ионное уравнение:
$NH_4^+ + Cl^- + Ag^+ + NO_3^- = AgCl \downarrow + NH_4^+ + NO_3^-$
Краткое ионное уравнение:
$Ag^+ + Cl^- = AgCl \downarrow$
Специфические свойства
1. Взаимодействие со щелочами при нагревании. Выделяется аммиак, что является качественной реакцией на ион аммония.
Молекулярное уравнение:
$NH_4Cl + NaOH \xrightarrow{t} NaCl + NH_3 \uparrow + H_2O$
Полное ионное уравнение:
$NH_4^+ + Cl^- + Na^+ + OH^- \xrightarrow{t} Na^+ + Cl^- + NH_3 \uparrow + H_2O$
Краткое ионное уравнение:
$NH_4^+ + OH^- \xrightarrow{t} NH_3 \uparrow + H_2O$
2. Термическое разложение (сублимация с разложением).
Молекулярное уравнение:
$NH_4Cl(тв.) \rightleftharpoons NH_3(г) + HCl(г)$
Ответ: Уравнения реакций, иллюстрирующие общие и специфические свойства хлорида аммония, приведены выше.
(NH₄)₂CO₃ (Карбонат аммония)
Химические свойства, общие с другими солями
Взаимодействие с сильными кислотами. Выделяется углекислый газ, что является качественной реакцией на карбонат-ион.
Молекулярное уравнение:
$(NH_4)_2CO_3 + 2HCl = 2NH_4Cl + H_2O + CO_2 \uparrow$
Полное ионное уравнение:
$2NH_4^+ + CO_3^{2-} + 2H^+ + 2Cl^- = 2NH_4^+ + 2Cl^- + H_2O + CO_2 \uparrow$
Краткое ионное уравнение:
$CO_3^{2-} + 2H^+ = H_2O + CO_2 \uparrow$
Специфические свойства
1. Взаимодействие со щелочами при нагревании (качественная реакция на ион аммония).
Молекулярное уравнение:
$(NH_4)_2CO_3 + 2NaOH \xrightarrow{t} Na_2CO_3 + 2NH_3 \uparrow + 2H_2O$
Полное ионное уравнение:
$2NH_4^+ + CO_3^{2-} + 2Na^+ + 2OH^- \xrightarrow{t} 2Na^+ + CO_3^{2-} + 2NH_3 \uparrow + 2H_2O$
Краткое ионное уравнение:
$NH_4^+ + OH^- \xrightarrow{t} NH_3 \uparrow + H_2O$
2. Термическая неустойчивость. Легко разлагается при нагревании и даже при комнатной температуре.
Молекулярное уравнение:
$(NH_4)_2CO_3(тв.) \xrightarrow{t} 2NH_3(г) + CO_2(г) + H_2O(г)$
3. Гидролиз по катиону и аниону, так как соль образована слабым основанием и слабой кислотой. Среда раствора слабощелочная.
Ответ: Уравнения реакций, иллюстрирующие общие и специфические свойства карбоната аммония, приведены выше.
(NH₄)₂S (Сульфид аммония)
Химические свойства, общие с другими солями
Взаимодействие с солями тяжелых металлов с образованием нерастворимых сульфидов.
Молекулярное уравнение:
$(NH_4)_2S + CuSO_4 = CuS \downarrow + (NH_4)_2SO_4$
Полное ионное уравнение:
$2NH_4^+ + S^{2-} + Cu^{2+} + SO_4^{2-} = CuS \downarrow + 2NH_4^+ + SO_4^{2-}$
Краткое ионное уравнение:
$Cu^{2+} + S^{2-} = CuS \downarrow$
Специфические свойства
1. Взаимодействие со щелочами при нагревании (качественная реакция на ион аммония).
Молекулярное уравнение:
$(NH_4)_2S + 2NaOH \xrightarrow{t} Na_2S + 2NH_3 \uparrow + 2H_2O$
Полное ионное уравнение:
$2NH_4^+ + S^{2-} + 2Na^+ + 2OH^- \xrightarrow{t} 2Na^+ + S^{2-} + 2NH_3 \uparrow + 2H_2O$
Краткое ионное уравнение:
$NH_4^+ + OH^- \xrightarrow{t} NH_3 \uparrow + H_2O$
2. Полный и необратимый гидролиз в водном растворе, так как соль образована очень слабым основанием и очень слабой кислотой.
Молекулярное уравнение:
$(NH_4)_2S + 2H_2O \rightleftharpoons 2(NH_3 \cdot H_2O) + H_2S \uparrow$
Ответ: Уравнения реакций, иллюстрирующие общие и специфические свойства сульфида аммония, приведены выше.
(NH₄)₂SO₄ (Сульфат аммония)
Химические свойства, общие с другими солями
Взаимодействие с солями бария с образованием нерастворимого сульфата бария (качественная реакция на сульфат-ион).
Молекулярное уравнение:
$(NH_4)_2SO_4 + BaCl_2 = BaSO_4 \downarrow + 2NH_4Cl$
Полное ионное уравнение:
$2NH_4^+ + SO_4^{2-} + Ba^{2+} + 2Cl^- = BaSO_4 \downarrow + 2NH_4^+ + 2Cl^-$
Краткое ионное уравнение:
$Ba^{2+} + SO_4^{2-} = BaSO_4 \downarrow$
Специфические свойства
1. Взаимодействие со щелочами при нагревании (качественная реакция на ион аммония).
Молекулярное уравнение:
$(NH_4)_2SO_4 + 2NaOH \xrightarrow{t} Na_2SO_4 + 2NH_3 \uparrow + 2H_2O$
Полное ионное уравнение:
$2NH_4^+ + SO_4^{2-} + 2Na^+ + 2OH^- \xrightarrow{t} 2Na^+ + SO_4^{2-} + 2NH_3 \uparrow + 2H_2O$
Краткое ионное уравнение:
$NH_4^+ + OH^- \xrightarrow{t} NH_3 \uparrow + H_2O$
2. Гидролиз по катиону. Соль образована слабым основанием и сильной кислотой, поэтому водный раствор имеет кислую среду ($pH < 7$).
Ионное уравнение гидролиза:
$NH_4^+ + H_2O \rightleftharpoons NH_3 \cdot H_2O + H^+$
Ответ: Уравнения реакций, иллюстрирующие общие и специфические свойства сульфата аммония, приведены выше.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 3 расположенного на странице 91 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 91), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















