Практическая работа 5, страница 87 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 5. Азот и фосфор. Параграф 25. Практическая работа 5. Получение аммиака и изучение его свойств - страница 87.
Практическая работа 5 (с. 87)
Условие. Практическая работа 5 (с. 87)
скриншот условия


● Вспомните правила техники безопасности при работе в химическом кабинете
1. Получение аммиака и растворение его в воде
1) В фарфоровой ступке хорошо перемешайте приблизительно равные объёмы кристаллического хлорида аммония $NH_4Cl$ и порошка гидроксида кальция $Ca(OH)_2$ (опыт удаётся лучше, если известь слегка влажная). Приготовленную смесь насыпьте в пробирку на $1/3$ её объёма. Закройте пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закреплённую в штативе открытым концом вниз (рис. 22). Нагрейте смесь в пробирке.
2) Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите её в сосуд с водой и откройте пробку.
3) После заполнения пробирки водой закройте её отверстие пробкой и выньте пробирку из воды. Половину полученного раствора перелейте в другую пробирку. В одну пробирку поместите красную лакмусовую бумагу. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты.
О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диссоциации?
Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции.
Рис. 22. Получение аммиака
2. Горение аммиака в кислороде
Снова слегка нагрейте пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку введите в стеклянный цилиндр с кислородом $O_2$ и при помощи лучинки подожгите газ (рис. 23).
Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
Рис. 23. Горение аммиака в кислороде
3. Взаимодействие аммиака с кислотами
В приборе для получения газов замените пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5–6 мм от поверхности кислоты.
Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций.
Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней?
4. Отчёт о работе оформите в виде таблицы (см. § 16).
Решение. Практическая работа 5 (с. 87)

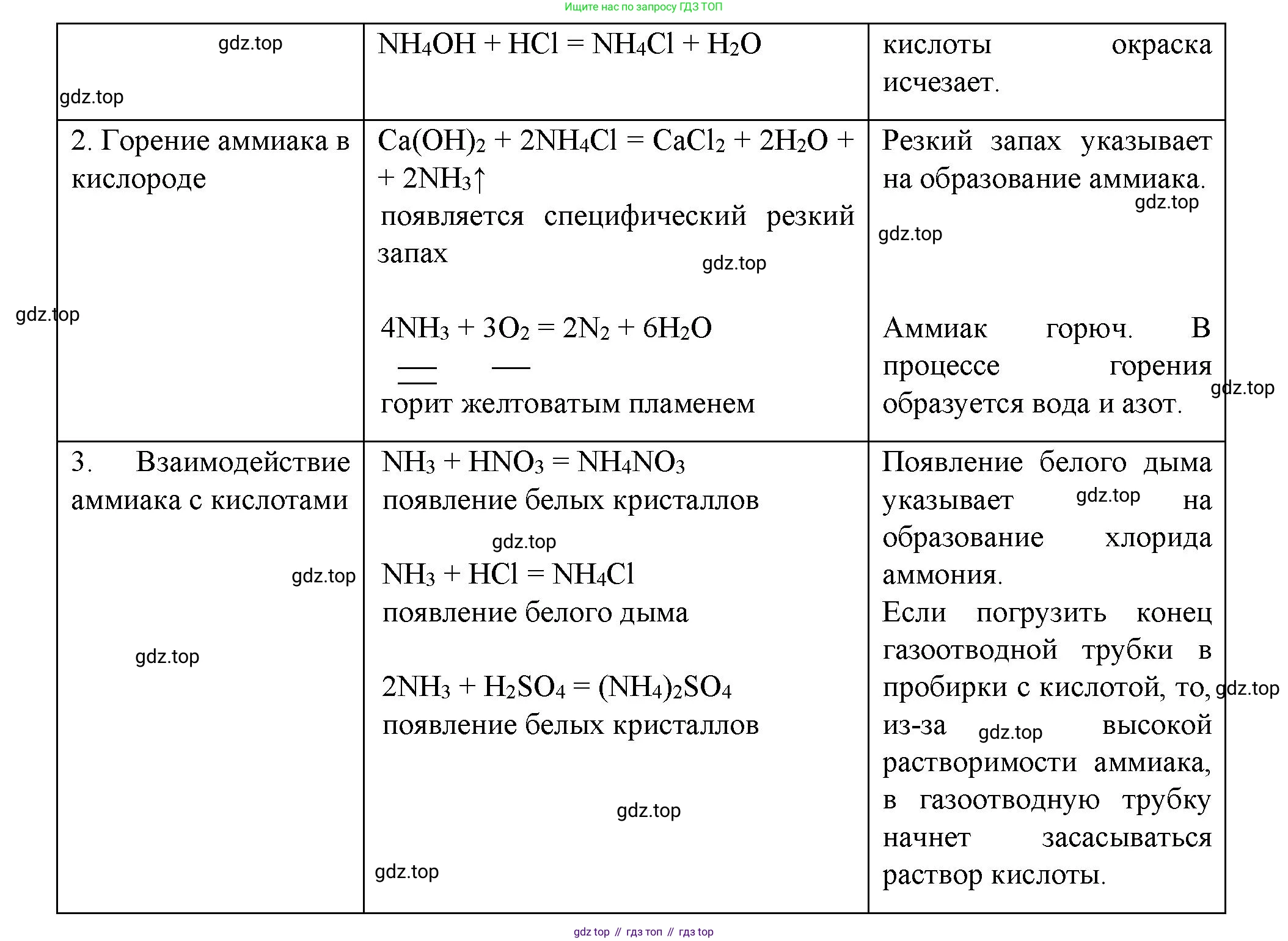
Решение 2. Практическая работа 5 (с. 87)
1. Получение аммиака и растворение его в воде
О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диссоциации?
Изменение цвета индикаторов (красная лакмусовая бумага синеет, а раствор фенолфталеина приобретает малиновую окраску) свидетельствует о том, что водный раствор аммиака имеет щелочную среду, то есть проявляет основные свойства.
С позиций теории электролитической диссоциации это объясняется следующим образом. При растворении в воде аммиак $NH_3$ обратимо взаимодействует с молекулами воды $H_2O$ с образованием гидрата аммиака (гидроксида аммония) $NH_3 \cdot H_2O$. Это слабое основание, которое в незначительной степени диссоциирует на ионы аммония $NH_4^+$ и гидроксид-ионы $OH^-$.
Уравнение процесса: $NH_3 + H_2O \rightleftharpoons NH_3 \cdot H_2O \rightleftharpoons NH_4^+ + OH^-$
Именно наличие в растворе избытка гидроксид-ионов $OH^-$ по сравнению с ионами водорода $H^+$ и обуславливает щелочную среду раствора.
Ответ: Действие на индикаторы свидетельствует об основных свойствах водного раствора аммиака (щелочной среде). Это объясняется обратимой реакцией аммиака с водой с образованием слабого основания — гидрата аммиака, который диссоциирует на ионы $NH_4^+$ и $OH^-$. Накопление гидроксид-ионов $OH^-$ и обуславливает щелочную среду.
Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции.
При добавлении кислоты к водному раствору аммиака происходит реакция нейтрализации. Основные свойства раствора аммиака обусловлены наличием гидрата аммония $NH_3 \cdot H_2O$, который реагирует с кислотой с образованием соли и воды. Например, при добавлении соляной кислоты $HCl$ образуется соль хлорид аммония $NH_4Cl$.
Ответ: При действии кислоты на водный раствор аммиака происходит реакция нейтрализации с образованием соли и воды. Уравнение реакции с соляной кислотой: $NH_3 \cdot H_2O + HCl \rightarrow NH_4Cl + H_2O$.
2. Горение аммиака в кислороде
Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
При горении аммиака в чистом кислороде (без катализатора) образуются простые вещества: молекулярный азот $N_2$ и вода $H_2O$.
Это окислительно-восстановительная реакция. Чтобы определить окислитель и восстановитель, рассмотрим изменение степеней окисления:
- Азот в аммиаке $N^{-3}H_3$ имеет степень окисления -3, а в продукте $N_2^0$ — 0. Степень окисления повышается, значит, аммиак отдает электроны и является восстановителем.
- Кислород в простом веществе $O_2^0$ имеет степень окисления 0, а в воде $H_2O^{-2}$ — -2. Степень окисления понижается, значит, кислород принимает электроны и является окислителем.
Ответ: В процессе горения аммиака в кислороде образуются азот $N_2$ и вода $H_2O$. Уравнение реакции: $4\underline{\underline{NH_3}} + 3\underline{O_2} \rightarrow 2N_2 + 6H_2O$, где $NH_3$ — восстановитель (условно подчеркнут двумя чертами), а $O_2$ — окислитель (условно подчеркнут одной чертой).
3. Взаимодействие аммиака с кислотами
Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций.
Появление «белого дыма» при взаимодействии газообразного аммиака с концентрированными кислотами объясняется образованием мельчайших твердых кристалликов солей аммония. Эти частицы, взвешенные в воздухе, образуют аэрозоль, который визуально воспринимается как дым.
Аммиак $NH_3$ реагирует с летучими парами кислот (например, хлороводорода $HCl$ из соляной кислоты и паров азотной кислоты $HNO_3$) или непосредственно с поверхностью нелетучей серной кислоты $H_2SO_4$.
Уравнения соответствующих реакций:
- С соляной кислотой: $NH_3(г) + HCl(г) \rightarrow NH_4Cl(т)$
- С азотной кислотой: $NH_3(г) + HNO_3(г) \rightarrow NH_4NO_3(т)$
- С серной кислотой: $2NH_3(г) + H_2SO_4(конц.) \rightarrow (NH_4)_2SO_4(т)$
Ответ: Появление белого дыма объясняется образованием мельчайших твердых частиц солей аммония в результате реакции газообразного аммиака с парами кислот. Уравнения реакций: $NH_3(г) + HCl(г) \rightarrow NH_4Cl(т)$; $NH_3(г) + HNO_3(г) \rightarrow NH_4NO_3(т)$; $2NH_3(г) + H_2SO_4(конц.) \rightarrow (NH_4)_2SO_4(т)$.
Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней?
Аммиак ($NH_3$) — газ, который чрезвычайно хорошо растворяется в воде, а концентрированные кислоты являются водными растворами. Если опустить конец газоотводной трубки в жидкость, аммиак начнет очень быстро растворяться и реагировать с кислотой. Это вызовет резкое падение давления в пробирке, где получают газ. В результате более высокое атмосферное давление "засосет" кислоту из стакана обратно в горячую пробирку. Этот эффект "засасывания" может привести к тому, что горячая пробирка треснет от резкого перепада температур (термический удар), что опасно разбрызгиванием горячей концентрированной кислоты.
Ответ: Конец газоотводной трубки нельзя погружать в кислоту из-за очень высокой растворимости аммиака. Быстрое растворение газа приведет к резкому падению давления в приборе и "засасыванию" кислоты в горячую пробирку, что может вызвать ее разрушение и разбрызгивание реагентов.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения Практическая работа 5 расположенного на странице 87 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Практическая работа 5 (с. 87), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















