Номер 4, страница 91 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 5. Азот и фосфор. Параграф 26. Соли аммония. Подумай, ответь, выполни... - номер 4, страница 91.
№4 (с. 91)
Условие. №4 (с. 91)
скриншот условия

4. 10,7 г хлорида аммония смешали с гидроксидом кальция и смесь нагрели. Какой газ выделился? Рассчитайте его массу и объём (н. у.).
Решение. №4 (с. 91)

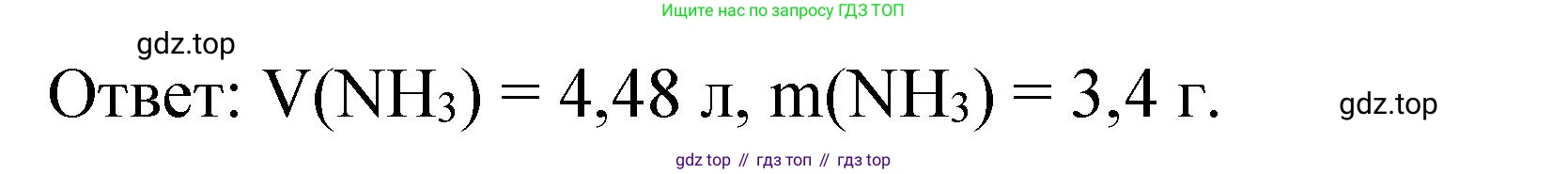
Решение 2. №4 (с. 91)
Дано:
$m(NH_4Cl) = 10,7$ г
$m(NH_4Cl) = 0,0107 \text{ кг}$
Найти:
Газ - ?
$m(\text{газа})$ - ?
$V(\text{газа})_{\text{н.у.}}$ - ?
Решение:
Какой газ выделился?
При нагревании смеси хлорида аммония с гидроксидом кальция происходит реакция обмена. Соли аммония при взаимодействии со щелочами выделяют аммиак. Уравнение реакции выглядит следующим образом:
$2NH_4Cl + Ca(OH)_2 \xrightarrow{t} CaCl_2 + 2NH_3\uparrow + 2H_2O$
Из уравнения следует, что выделяющийся газ — это аммиак ($NH_3$).
Ответ: Выделился аммиак ($NH_3$).
Рассчитайте его массу и объём (н. у.).
Для расчета массы и объема выделившегося газа необходимо сначала найти количество вещества исходного реагента — хлорида аммония.
1. Вычислим молярную массу хлорида аммония ($NH_4Cl$):
$M(NH_4Cl) = M(N) + 4 \cdot M(H) + M(Cl) = 14 + 4 \cdot 1 + 35,5 = 53,5$ г/моль.
2. Найдем количество вещества ($n$) хлорида аммония, содержащееся в 10,7 г:
$n(NH_4Cl) = \frac{m(NH_4Cl)}{M(NH_4Cl)} = \frac{10,7 \text{ г}}{53,5 \text{ г/моль}} = 0,2$ моль.
3. Согласно стехиометрическим коэффициентам в уравнении реакции, из 2 моль хлорида аммония образуется 2 моль аммиака. Следовательно, их количества вещества соотносятся как 1:1.
$n(NH_3) = n(NH_4Cl) = 0,2$ моль.
4. Теперь можно рассчитать массу выделившегося аммиака. Молярная масса аммиака ($NH_3$):
$M(NH_3) = M(N) + 3 \cdot M(H) = 14 + 3 \cdot 1 = 17$ г/моль.
Масса аммиака равна:
$m(NH_3) = n(NH_3) \cdot M(NH_3) = 0,2 \text{ моль} \cdot 17 \text{ г/моль} = 3,4$ г.
5. Объём аммиака при нормальных условиях (н. у.) рассчитывается с использованием молярного объёма газов, который составляет $V_m = 22,4$ л/моль.
$V(NH_3) = n(NH_3) \cdot V_m = 0,2 \text{ моль} \cdot 22,4 \text{ л/моль} = 4,48$ л.
Ответ: Масса выделившегося аммиака составляет 3,4 г, а его объём при нормальных условиях — 4,48 л.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 4 расположенного на странице 91 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 91), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















