Номер 167, страница 281 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 10. Строение вещества. 10.3. Строение твёрдых веществ. Кристаллические структуры. Уровень 2 - номер 167, страница 281.
№167 (с. 281)
Условие. №167 (с. 281)

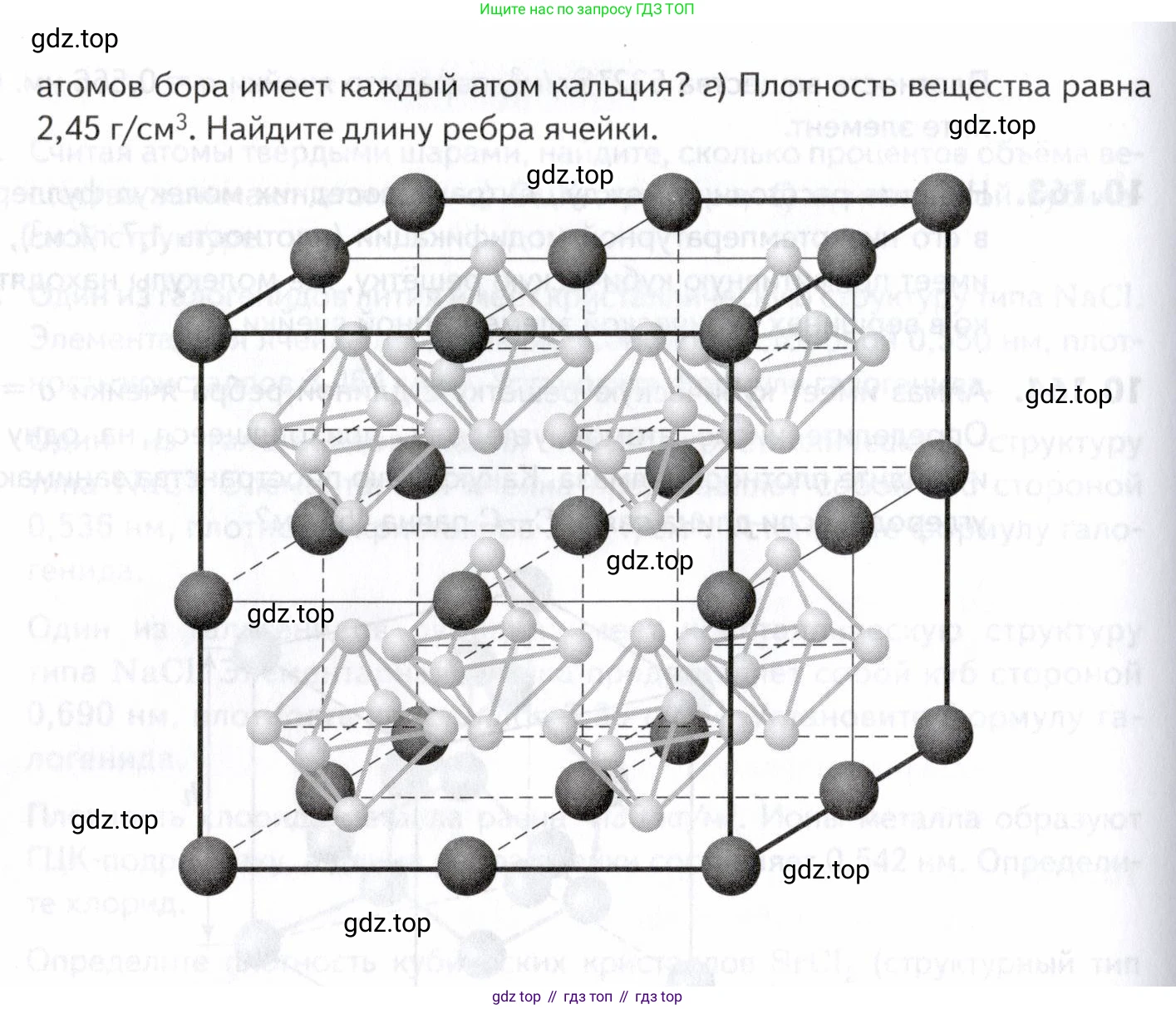
10.167. Кальций и бор образуют соединение необычного состава, в котором массовая доля одного из элементов составляет 38,17%. а) Установите формулу соединения, б) Сколько формульных единиц содержит изображённая на рисунке ячейка? в) Сколько ближайших соседей – атомов бора имеет каждый атом кальция? г) Плотность вещества равна 2,45 Найдите длину ребра ячейки.
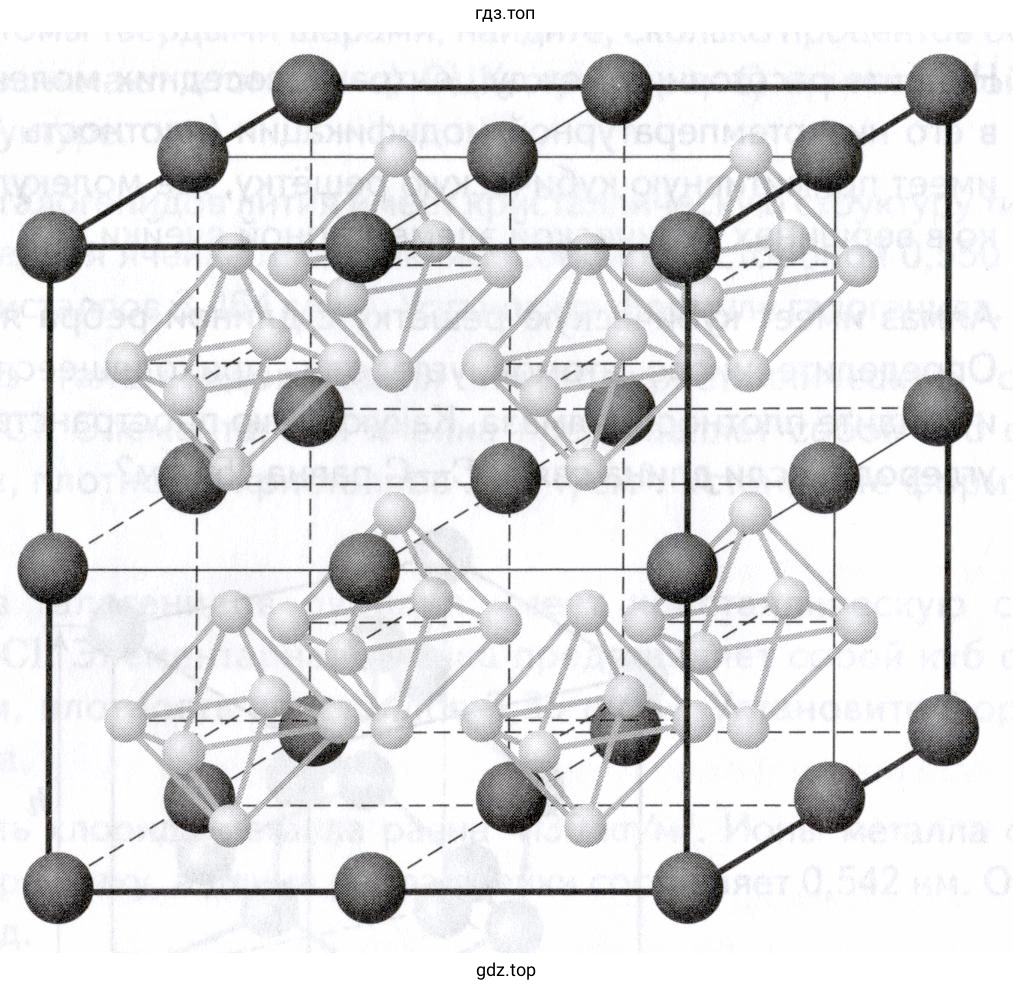
Решение 3. №167 (с. 281)
а) Установите формулу соединения.
Для определения формулы соединения $Ca_x B_y$ необходимо найти соотношение индексов $x$ и $y$. Для этого рассмотрим два возможных случая, исходя из того, какому элементу принадлежит массовая доля $38,17\%$. Примем массу образца за 100 г.
Случай 1: Массовая доля кальция $ω(Ca) = 38,17\%$.
Тогда масса кальция в образце $m(Ca) = 38,17 \text{ г}$, а масса бора $m(B) = 100 - 38,17 = 61,83 \text{ г}$.
Найдем количество вещества (моль) для каждого элемента, используя молярные массы $M(Ca) \approx 40,08 \text{ г/моль}$ и $M(B) \approx 10,81 \text{ г/моль}$.
$n(Ca) = \frac{m(Ca)}{M(Ca)} = \frac{38,17 \text{ г}}{40,08 \text{ г/моль}} \approx 0,9523 \text{ моль}$
$n(B) = \frac{m(B)}{M(B)} = \frac{61,83 \text{ г}}{10,81 \text{ г/моль}} \approx 5,7197 \text{ моль}$
Соотношение индексов $x : y$ равно соотношению количеств вещества $n(Ca) : n(B)$.
$x : y \approx 0,9523 : 5,7197$
Разделим оба числа на наименьшее ($0,9523$):
$x : y \approx \frac{0,9523}{0,9523} : \frac{5,7197}{0,9523} \approx 1 : 6,006 \approx 1 : 6$
Таким образом, простейшая формула соединения — $CaB_6$.
Случай 2: Массовая доля бора $ω(B) = 38,17\%$.
Тогда масса бора $m(B) = 38,17 \text{ г}$, а масса кальция $m(Ca) = 100 - 38,17 = 61,83 \text{ г}$.
$n(B) = \frac{m(B)}{M(B)} = \frac{38,17 \text{ г}}{10,81 \text{ г/моль}} \approx 3,531 \text{ моль}$
$n(Ca) = \frac{m(Ca)}{M(Ca)} = \frac{61,83 \text{ г}}{40,08 \text{ г/моль}} \approx 1,5427 \text{ моль}$
$x : y = n(Ca) : n(B) \approx 1,5427 : 3,531$
Разделим оба числа на наименьшее ($1,5427$):
$x : y \approx \frac{1,5427}{1,5427} : \frac{3,531}{1,5427} \approx 1 : 2,289$
Это соотношение не приводит к целым числам. Следовательно, верен первый случай.
Ответ: Формула соединения — $CaB_6$.
б) Сколько формульных единиц содержит изображённая на рисунке ячейка?
На рисунке изображена элементарная ячейка кристалла. Атомы кальция (тёмные шары) расположены в вершинах куба, а атомы бора (светлые шары) образуют октаэдрический кластер $B_6$ в центре куба.
Подсчитаем число атомов каждого вида в ячейке:
- Атомы кальция (Ca) находятся в 8 вершинах куба. Каждый атом в вершине принадлежит 8 смежным ячейкам, поэтому вклад каждого в данную ячейку составляет $1/8$.
Число атомов Ca = $8 \text{ вершин} \times \frac{1}{8} \text{ атома/вершину} = 1$ атом. - Атомы бора (B) образуют кластер из 6 атомов ($B_6$), который полностью находится внутри ячейки (в её центре).
Число атомов B = $6 \text{ атомов} \times 1 = 6$ атомов.
Таким образом, на одну элементарную ячейку приходится 1 атом кальция и 6 атомов бора. Состав ячейки ($Ca_1 B_6$) соответствует формуле соединения $CaB_6$. Формульная единица — это $CaB_6$. Следовательно, ячейка содержит одну формульную единицу.
Ответ: Изображённая на рисунке ячейка содержит 1 формульную единицу.
в) Сколько ближайших соседей — атомов бора имеет каждый атом кальция?
Атом кальция расположен в вершине кубической ячейки. Эта вершина является общей для 8 смежных элементарных ячеек. В центре каждой из этих 8 ячеек находится октаэдрический кластер $B_6$. Таким образом, каждый атом кальция окружён 8 кластерами $B_6$.
Рассмотрим атом кальция в начале координат $(0, 0, 0)$ и один из окружающих его кластеров $B_6$, центр которого находится в точке $(\frac{a}{2}, \frac{a}{2}, \frac{a}{2})$, где $a$ — ребро куба. Шесть атомов бора этого кластера расположены симметрично вокруг его центра. Три из них будут находиться на меньшем расстоянии от атома кальция, чем три других. Эти три ближайших атома бора из одного кластера равноудалены от атома кальция.
Поскольку атом кальция окружён 8 такими кластерами, и каждый кластер предоставляет 3 ближайших атома бора, общее число ближайших соседей (координационное число кальция по бору) равно:
$8 \text{ кластеров} \times 3 \text{ атома бора/кластер} = 24 \text{ атома бора}$
Ответ: Каждый атом кальция имеет 24 ближайших соседа — атомов бора.
г) Плотность вещества равна 2,45 г/см³. Найдите длину ребра ячейки.
Дано:
Формула соединения: $CaB_6$ (из пункта а))
Число формульных единиц в ячейке $Z = 1$ (из пункта б))
Молярная масса кальция $M(Ca) \approx 40,08 \text{ г/моль}$
Молярная масса бора $M(B) \approx 10,81 \text{ г/моль}$
Число Авогадро $N_A \approx 6,022 \cdot 10^{23} \text{ моль}^{-1}$
Перевод в СИ:
Найти:
Решение:
Плотность кристаллического вещества связана с параметрами элементарной ячейки формулой:
$ρ = \frac{Z \cdot M}{V \cdot N_A}$
где $V$ — объём ячейки. Для кубической ячейки $V = a^3$.
Выразим объём ячейки:
$a^3 = V = \frac{Z \cdot M}{ρ \cdot N_A}$
1. Рассчитаем молярную массу $M$ для $CaB_6$:
$M(CaB_6) = M(Ca) + 6 \cdot M(B) = 40,08 + 6 \cdot 10,81 = 40,08 + 64,86 = 104,94 \text{ г/моль}$
2. Подставим значения в формулу для объёма (используя г и см):
$a^3 = \frac{1 \cdot 104,94 \text{ г/моль}}{2,45 \text{ г/см}^3 \cdot 6,022 \cdot 10^{23} \text{ моль}^{-1}} \approx \frac{104,94}{14,7539 \cdot 10^{23}} \text{ см}^3 \approx 7,1127 \cdot 10^{-23} \text{ см}^3$
3. Найдём длину ребра $a$, извлекая кубический корень из объёма:
$a = \sqrt[3]{7,1127 \cdot 10^{-23} \text{ см}^3} = \sqrt[3]{71,127 \cdot 10^{-24} \text{ см}^3} \approx 4,143 \cdot 10^{-8} \text{ см}$
Результат можно выразить в нанометрах ($1 \text{ нм} = 10^{-7} \text{ см}$) или пикометрах ($1 \text{ пм} = 10^{-10} \text{ см}$):
$a \approx 0,4143 \text{ нм} = 414,3 \text{ пм}$
Ответ: Длина ребра ячейки равна $4,143 \cdot 10^{-8} \text{ см}$ (или $0,4143 \text{ нм}$).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 167 расположенного на странице 281 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №167 (с. 281), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















