Номер 162, страница 280 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 10. Строение вещества. 10.3. Строение твёрдых веществ. Кристаллические структуры. Уровень 2 - номер 162, страница 280.
№162 (с. 280)
Условие. №162 (с. 280)
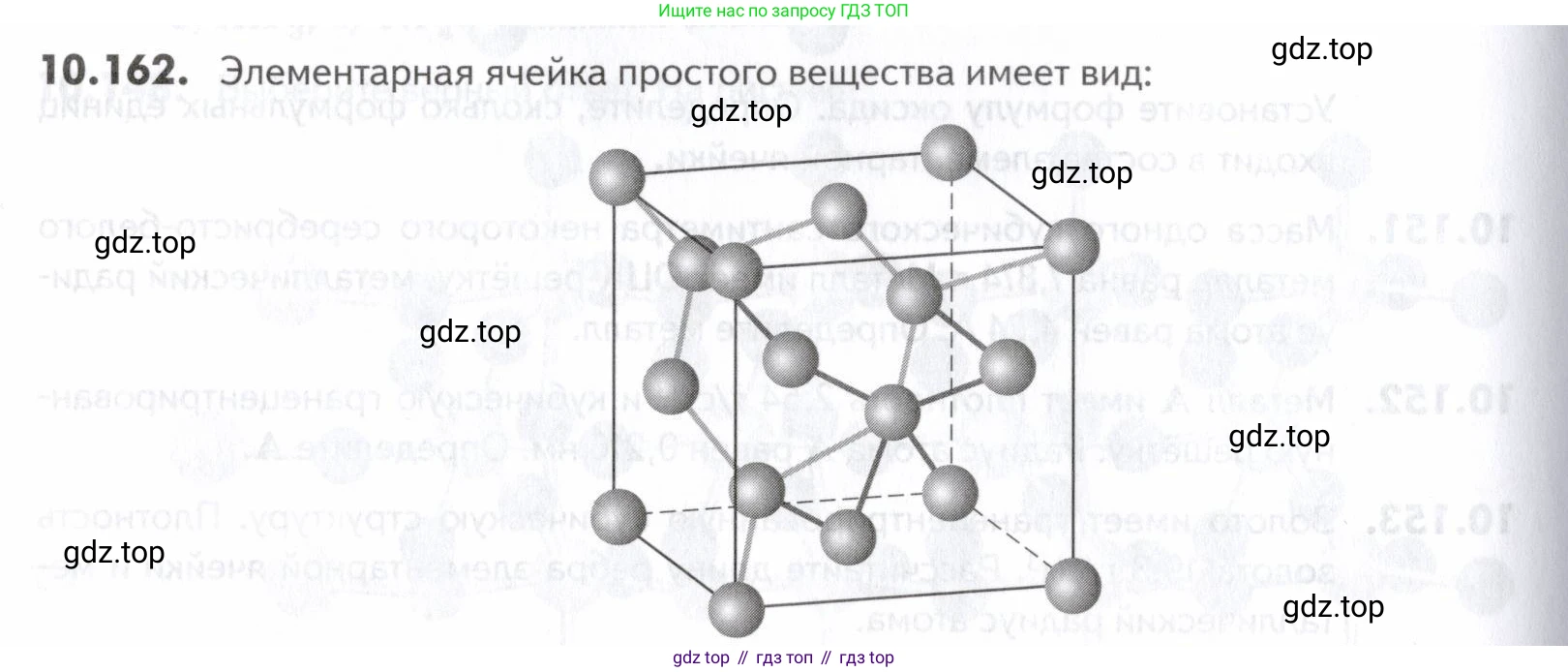

10.162. Элементарная ячейка простого вещества имеет вид:
Плотность вещества 5327 параметр ячейки Определите элемент.
Решение 3. №162 (с. 280)
Дано:
Тип элементарной ячейки: алмазная кубическая
Плотность вещества, $\rho = 5327$ кг/м³
Параметр ячейки, $a = 0,566$ нм
Перевод в систему СИ:
$a = 0,566 \times 10^{-9}$ м
Найти:
Элемент - ?
Решение:
Плотность вещества можно определить через параметры его кристаллической решетки по формуле: $\rho = \frac{m_{\text{ячейки}}}{V_{\text{ячейки}}}$ где $m_{\text{ячейки}}$ — масса всех атомов в одной элементарной ячейке, а $V_{\text{ячейки}}$ — объем элементарной ячейки.
Объем кубической ячейки равен $V_{\text{ячейки}} = a^3$, где $a$ — параметр ячейки.
Масса ячейки $m_{\text{ячейки}}$ равна произведению числа атомов в ячейке ($n$) на массу одного атома ($m_{\text{атома}}$): $m_{\text{ячейки}} = n \cdot m_{\text{атома}}$
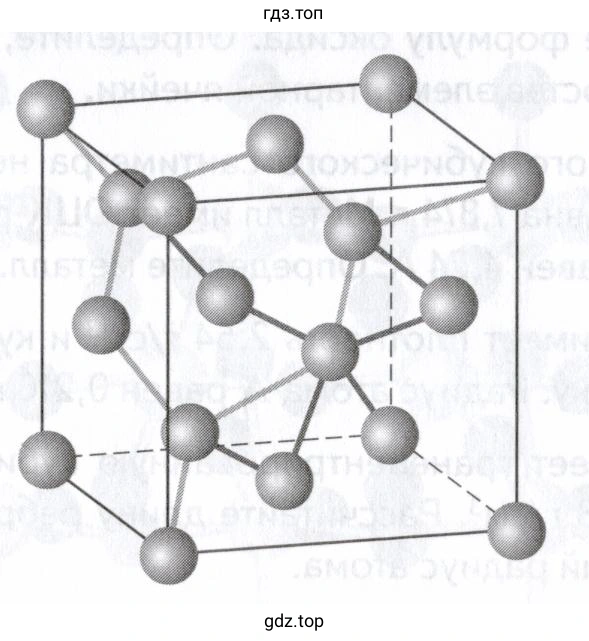
На изображении представлена элементарная ячейка алмазоподобной структуры. Такая ячейка содержит:
- 8 атомов в вершинах куба (каждый принадлежит 8 ячейкам, итого $8 \times 1/8 = 1$ атом)
- 6 атомов в центрах граней (каждый принадлежит 2 ячейкам, итого $6 \times 1/2 = 3$ атома)
- 4 атома внутри объема ячейки.
Массу одного атома можно выразить через молярную массу $M$ и число Авогадро $N_A = 6,022 \times 10^{23}$ моль⁻¹: $m_{\text{атома}} = \frac{M}{N_A}$
Объединив формулы, получим выражение для плотности: $\rho = \frac{n \cdot M}{a^3 \cdot N_A}$
Выразим из этой формулы молярную массу $M$: $M = \frac{\rho \cdot a^3 \cdot N_A}{n}$
Подставим известные значения и вычислим молярную массу: $M = \frac{5327 \text{ кг/м³} \cdot (0,566 \times 10^{-9} \text{ м})^3 \cdot 6,022 \times 10^{23} \text{ моль}^{-1}}{8}$ $M \approx \frac{5327 \cdot 0,1813 \times 10^{-27} \cdot 6,022 \times 10^{23}}{8} \text{ кг/моль}$ $M \approx \frac{5816,6 \times 10^{-4}}{8} \text{ кг/моль}$ $M \approx 727 \times 10^{-4} \text{ кг/моль} \approx 0,0727$ кг/моль
Переведем молярную массу в более привычные единицы г/моль: $M \approx 0,0727 \text{ кг/моль} \cdot 1000 \text{ г/кг} = 72,7$ г/моль.
Сравнив полученное значение с молярными массами элементов в периодической таблице Менделеева, находим, что наиболее близким элементом является Германий (Ge), молярная масса которого составляет 72,63 г/моль. Германий как раз имеет алмазоподобную кристаллическую решетку.
Ответ: Искомый элемент — Германий (Ge).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 162 расположенного на странице 280 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №162 (с. 280), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















