Номер 164, страница 281 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 10. Строение вещества. 10.3. Строение твёрдых веществ. Кристаллические структуры. Уровень 2 - номер 164, страница 281.
№164 (с. 281)
Условие. №164 (с. 281)
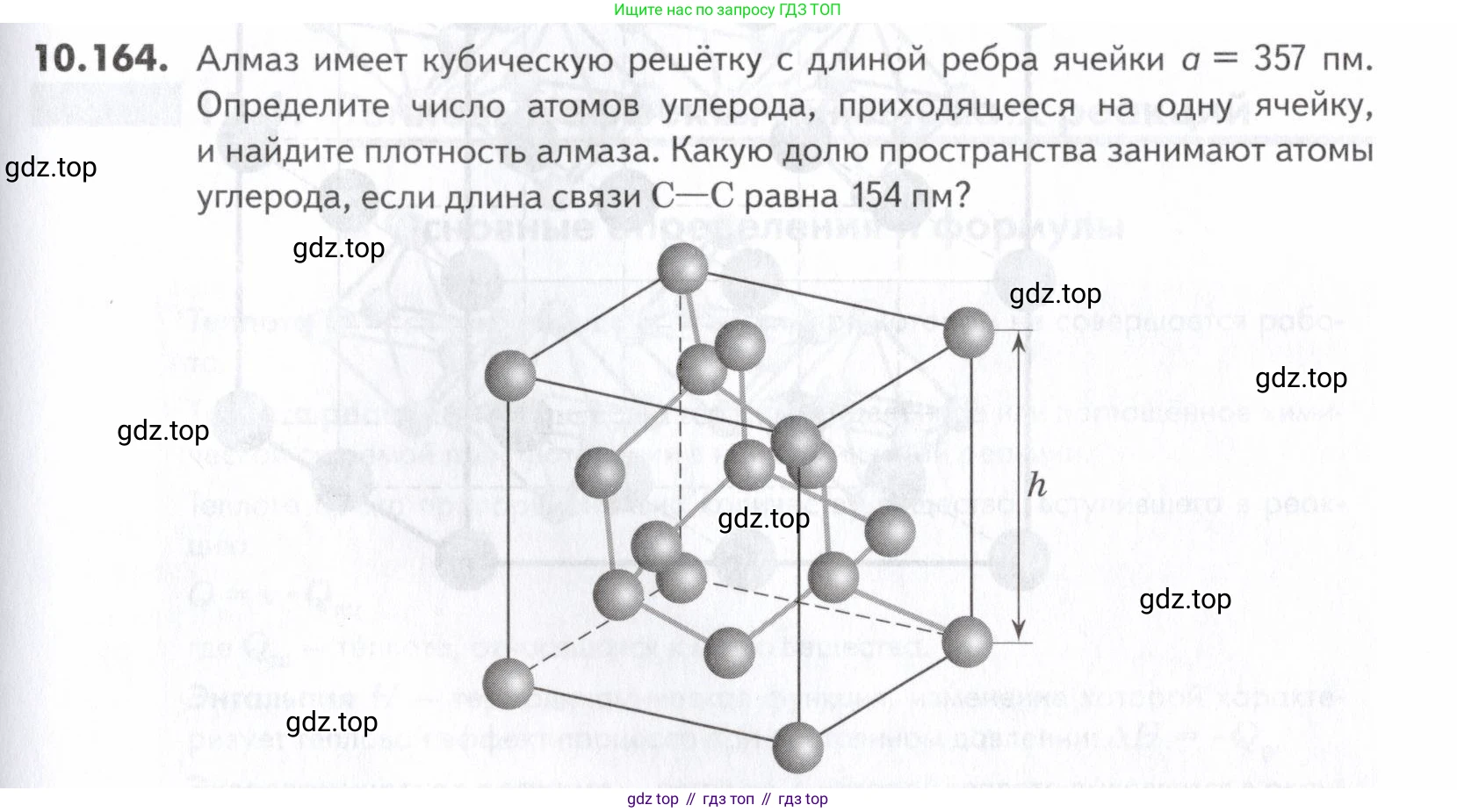
10.164. Алмаз имеет кубическую решётку с длиной ребра ячейки Определите число атомов углерода, приходящееся на одну ячейку, и найдите плотность алмаза. Какую долю пространства занимают атомы углерода, если длина связи С–С равна 154 пм?
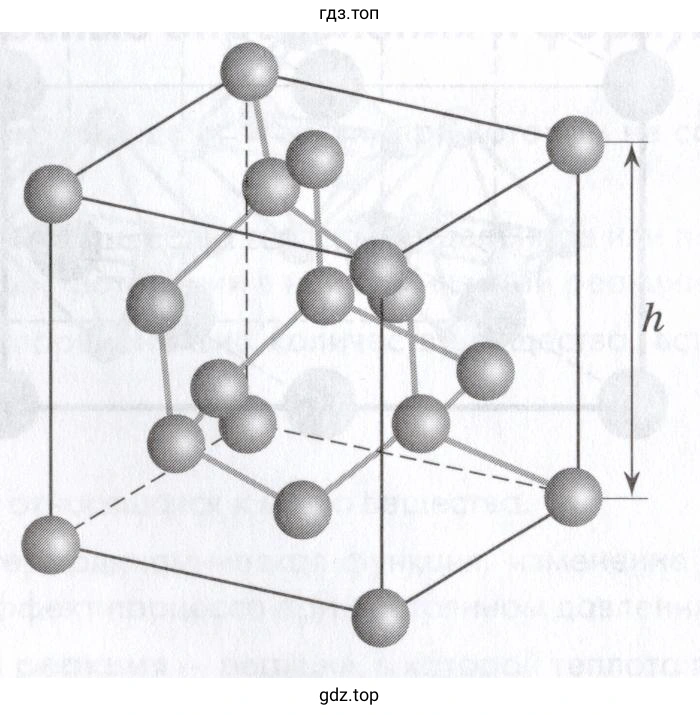
Решение 3. №164 (с. 281)
Дано:
Тип решётки - кубическая, алмазного типа.
Длина ребра элементарной ячейки $a = 357 \text{ пм}$.
Длина связи C—C $d = 154 \text{ пм}$.
Справочные данные:
Молярная масса углерода $M(C) = 12,011 \text{ г/моль}$.
Число Авогадро $N_A = 6,022 \times 10^{23} \text{ моль}^{-1}$.
$a = 357 \times 10^{-12} \text{ м} = 3,57 \times 10^{-10} \text{ м}$
$d = 154 \times 10^{-12} \text{ м} = 1,54 \times 10^{-10} \text{ м}$
$M(C) = 0,012011 \text{ кг/моль}$
Найти:
1. Число атомов на ячейку $n$ - ?
2. Плотность алмаза $\rho$ - ?
3. Доля пространства, занимаемая атомами $f$ - ?
Решение:
1. Определите число атомов углерода, приходящееся на одну ячейку
Кристаллическая решётка алмаза является разновидностью кубической гранецентрированной решётки. Атомы углерода в элементарной ячейке располагаются следующим образом:
- 8 атомов в вершинах куба. Каждый из этих атомов принадлежит одновременно 8 соседним ячейкам, поэтому вклад в одну ячейку составляет $8 \times \frac{1}{8} = 1$ атом.
- 6 атомов в центрах граней куба. Каждый из этих атомов принадлежит 2 соседним ячейкам, поэтому вклад в одну ячейку составляет $6 \times \frac{1}{2} = 3$ атома.
- 4 атома находятся полностью внутри объёма элементарной ячейки (в тетраэдрических пустотах). Их вклад равен 4 атомам.
Суммарное число атомов углерода $n$ на одну элементарную ячейку равно сумме этих вкладов:
$n = \left(8 \times \frac{1}{8}\right) + \left(6 \times \frac{1}{2}\right) + 4 = 1 + 3 + 4 = 8 \text{ атомов}$
Ответ: На одну элементарную ячейку приходится 8 атомов углерода.
2. Найдите плотность алмаза
Плотность $\rho$ определяется как отношение массы всех атомов в элементарной ячейке $m_{ячейки}$ к объёму ячейки $V_{ячейки}$:
$\rho = \frac{m_{ячейки}}{V_{ячейки}}$
Объём элементарной ячейки (куба) равен $V_{ячейки} = a^3$.
Масса ячейки равна произведению числа атомов в ячейке $n$ на массу одного атома углерода $m_C$. Массу одного атома можно найти, разделив молярную массу углерода $M(C)$ на число Авогадро $N_A$: $m_C = \frac{M(C)}{N_A}$.
Таким образом, $m_{ячейки} = n \times \frac{M(C)}{N_A}$.
Итоговая формула для плотности:
$\rho = \frac{n \cdot M(C)}{a^3 \cdot N_A}$
Подставим значения в системе СИ:
$\rho = \frac{8 \times 0,012011 \text{ кг/моль}}{(3,57 \times 10^{-10} \text{ м})^3 \times 6,022 \times 10^{23} \text{ моль}^{-1}} = \frac{0,096088 \text{ кг}}{(4,5503 \times 10^{-29} \text{ м}^3) \times (6,022 \times 10^{23})} \approx \frac{0,096088}{2,740 \times 10^{-5}} \text{ кг/м}^3 \approx 3506 \text{ кг/м}^3$
Ответ: Плотность алмаза составляет приблизительно $3506 \text{ кг/м}^3$ (или $3,506 \text{ г/см}^3$).
3. Какую долю пространства занимают атомы углерода, если длина связи C—C равна 154 пм?
Доля пространства $f$ (также называемая коэффициентом упаковки), занимаемая атомами, равна отношению суммарного объёма атомов в ячейке $V_{атомов}$ к объёму самой ячейки $V_{ячейки}$.
$f = \frac{V_{атомов}}{V_{ячейки}} = \frac{n \cdot V_{атома}}{a^3}$
Атомы углерода моделируются как шары. Объём одного атома (шара) вычисляется по формуле $V_{атома} = \frac{4}{3}\pi r^3$.
Радиус атома углерода $r$ принимаем равным половине длины связи C—C:
$r = \frac{d}{2} = \frac{154 \text{ пм}}{2} = 77 \text{ пм}$
Теперь можем найти долю занимаемого пространства. Для удобства расчётов можно оставить длины в пикометрах, так как единицы измерения сократятся.
$f = \frac{n \cdot \frac{4}{3}\pi r^3}{a^3} = \frac{8 \cdot \frac{4}{3}\pi (77 \text{ пм})^3}{(357 \text{ пм})^3} = \frac{32\pi \cdot 77^3}{3 \cdot 357^3} = \frac{32\pi \cdot 456533}{3 \cdot 45503373} \approx \frac{45904842}{136510119} \approx 0,3363$
Эта доля в процентах составляет $0,3363 \times 100\% = 33,63\%$.
Примечание: Теоретическое значение для идеальной алмазной решётки равно $\frac{\pi\sqrt{3}}{16} \approx 0,3401$, или 34,01%. Небольшое расхождение связано с тем, что приведённые в задаче значения $a=357$ пм и $d=154$ пм не строго соответствуют идеальной геометрии, в которой $d = a\sqrt{3}/4$.
Ответ: Атомы углерода занимают долю пространства, равную примерно 0,336, или 33,6%.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 164 расположенного на странице 281 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №164 (с. 281), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















