Номер 2, страница 109 - гдз по химии 10 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: коричневый
ISBN: 978-5-09-088084-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 10 классе
Глава VI. Спирты и фенолы. Параграф 22. Фенолы и ароматические спирты. Подумайте, ответьте, выполните... - номер 2, страница 109.
№2 (с. 109)
Условие. №2 (с. 109)
скриншот условия

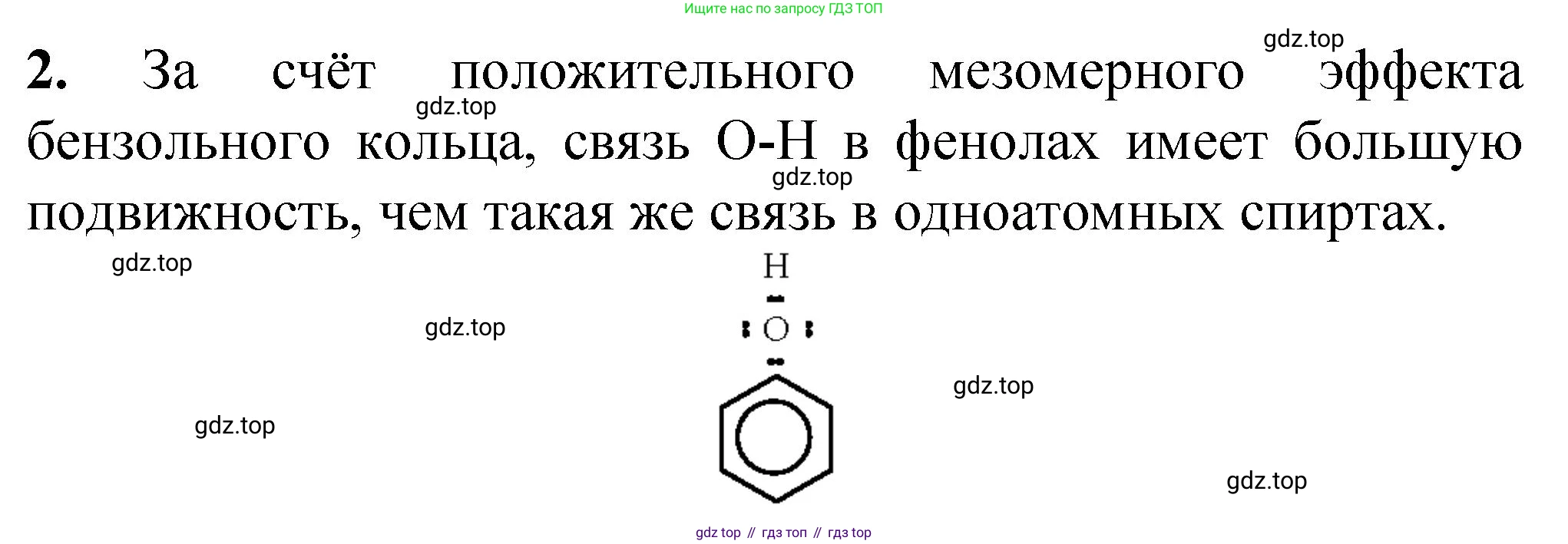
2. Составьте электронную формулу фенола и поясните, почему атом водорода в гидроксильной группе более подвижен, чем в молекулах одноатомных спиртов.
Решение. №2 (с. 109)
Решение 2. №2 (с. 109)
Молекула фенола имеет химическую формулу $C_6H_5OH$. Она состоит из бензольного кольца, с атомом углерода которого напрямую связана гидроксильная группа (–OH).
Электронная формула фенола (структурная формула Льюиса) показывает, что у атома кислорода в гидроксильной группе есть две неподеленные электронные пары. Ключевой особенностью электронного строения фенола является то, что одна из этих электронных пар находится на p-орбитали, параллельной p-орбиталям атомов углерода бензольного кольца. Это создает условия для p,$\pi$-сопряжения: неподеленная электронная пара кислорода вступает во взаимодействие с единой $\pi$-системой бензольного кольца, становясь ее частью.
Именно это явление сопряжения объясняет, почему атом водорода в гидроксильной группе фенола более подвижен, чем в молекулах одноатомных спиртов. Подвижность (или кислотность) атома водорода определяется полярностью связи O–H.
1. В молекуле фенола. В результате p,$\pi$-сопряжения электронная плотность от неподеленной пары кислорода смещается в сторону бензольного кольца. Это приводит к уменьшению электронной плотности на самом атоме кислорода. Вследствие этого атом кислорода сильнее притягивает к себе общую электронную пару связи O–H. Это усиливает полярность связи O–H, ослабляет ее и, как следствие, облегчает отщепление атома водорода в виде протона ($H^+$). Дополнительным фактором является высокая стабильность образующегося при диссоциации фенолят-аниона ($C_6H_5O^−$), в котором отрицательный заряд не сконцентрирован на атоме кислорода, а делокализован (распределен) по всей $\pi$-системе бензольного кольца, что энергетически выгодно.
2. В молекулах одноатомных спиртов (например, в этаноле $C_2H_5OH$). Гидроксильная группа здесь связана с алкильным радикалом (например, этилом $-C_2H_5$), который не имеет $\pi$-системы и не может участвовать в сопряжении. Напротив, алкильные группы проявляют положительный индуктивный эффект (+I), то есть являются донорами электронной плотности. Они смещают электронную плотность по $\sigma$-связи к атому кислорода, увеличивая на нем электронную плотность. Это, в свою очередь, уменьшает полярность связи O–H, делая ее более прочной, а атом водорода – менее подвижным.
Ответ: Электронная формула фенола характеризуется наличием p,$\pi$-сопряжения, при котором одна из неподеленных электронных пар атома кислорода взаимодействует с $\pi$-системой бензольного кольца. Это взаимодействие оттягивает электронную плотность от атома кислорода, что сильно увеличивает полярность связи O–H и делает атом водорода в гидроксильной группе более подвижным. В одноатомных спиртах, напротив, алкильный радикал проявляет положительный индуктивный эффект (+I), насыщая атом кислорода электронами, что уменьшает полярность связи O–H и подвижность атома водорода.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 2 расположенного на странице 109 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 109), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.




















