Номер 6, страница 110 - гдз по химии 10 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: коричневый
ISBN: 978-5-09-088084-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 10 классе
Глава VI. Спирты и фенолы. Параграф 22. Фенолы и ароматические спирты. Подумайте, ответьте, выполните... - номер 6, страница 110.
№6 (с. 110)
Условие. №6 (с. 110)
скриншот условия

6. Составьте конспект ответа, характеризующего фенол, по образцу, предложенному в задании 6 после § 9 (см. с. 42).
Решение. №6 (с. 110)
Решение 2. №6 (с. 110)
1. Определение, классификация и формула
Фенолы — это производные ароматических углеводородов, в молекулах которых гидроксильные группы (–OH) связаны непосредственно с атомами углерода бензольного кольца. Простейшим представителем этого класса является фенол (гидроксибензол, или карболовая кислота).
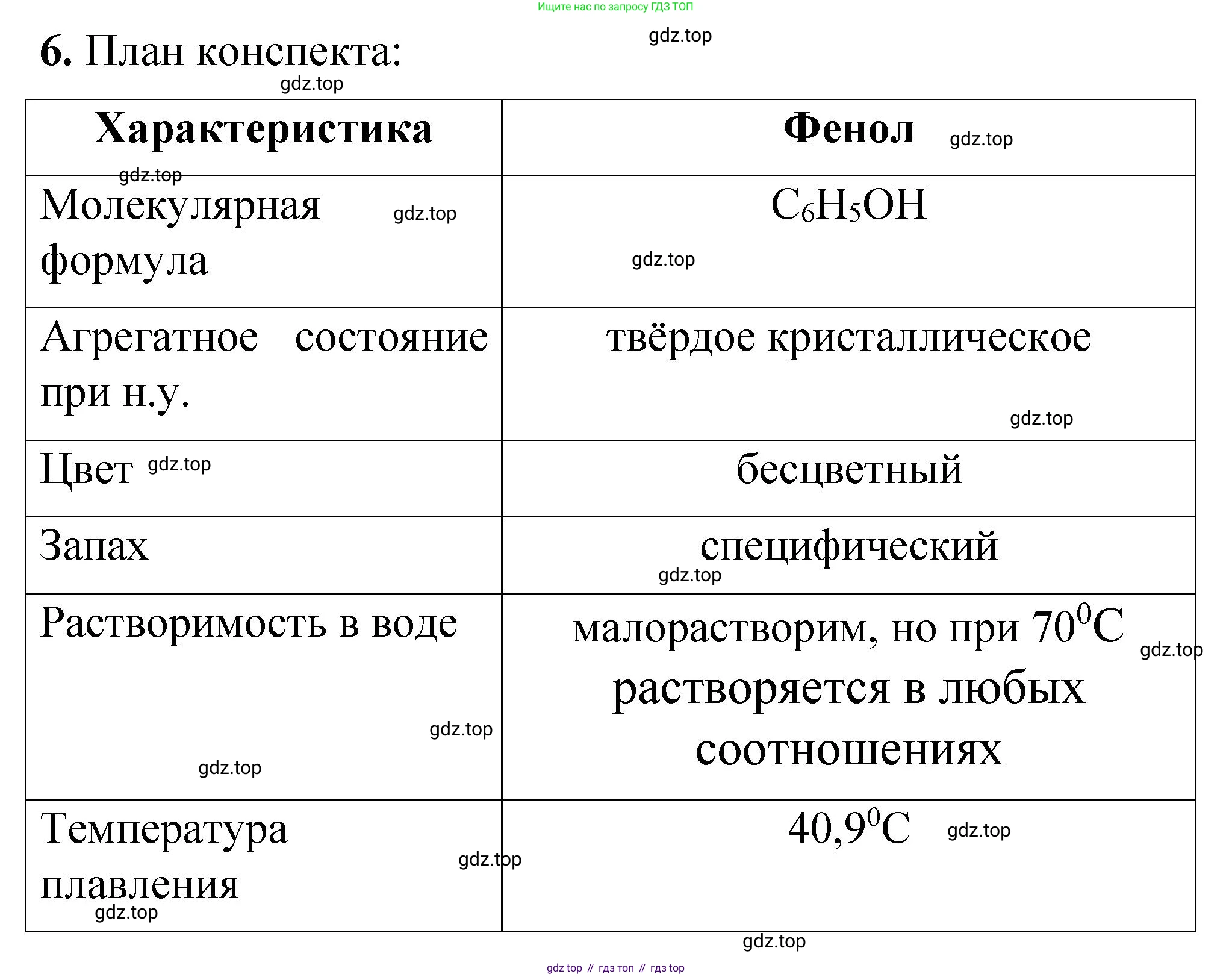
Молекулярная формула фенола: $C_6H_6O$.
Структурная формула: $C_6H_5OH$.
В молекуле фенола одна гидроксильная группа связана с бензольным кольцом.
Ответ: Фенол ($C_6H_5OH$) – это простейший представитель класса фенолов, органических соединений, в которых гидроксильная группа непосредственно связана с атомом углерода бензольного кольца.
2. Строение молекулы
Молекула фенола состоит из бензольного кольца и гидроксильной группы. Все шесть атомов углерода в кольце находятся в состоянии $sp^2$-гибридизации и образуют единую сопряженную $\pi$-систему. Атом кислорода гидроксильной группы также находится в $sp^2$-гибридизации. Вследствие этого одна из неподеленных электронных пар атома кислорода вступает в сопряжение с $\pi$-системой бензольного кольца (положительный мезомерный эффект, +М). Это приводит к:
1. Увеличению электронной плотности на бензольном кольце, особенно в орто- и пара-положениях (2, 4, 6), что облегчает реакции электрофильного замещения по этим положениям.
2. Смещению электронной плотности от атома кислорода к кольцу и, как следствие, к увеличению полярности связи O–H. Это усиливает кислотные свойства фенола по сравнению со спиртами.
Бензольное кольцо, в свою очередь, проявляет отрицательный индуктивный эффект (–I), оттягивая электронную плотность от гидроксильной группы. Однако +М-эффект является доминирующим.
Ответ: В молекуле фенола атом кислорода гидроксильной группы и атомы углерода бензольного кольца находятся в состоянии $sp^2$-гибридизации, что обусловливает взаимное влияние: неподеленная электронная пара кислорода взаимодействует с $\pi$-системой кольца (+M-эффект), повышая его реакционную способность и кислотность самой ОН-группы.
3. Физические свойства
При обычных условиях фенол — это бесцветное кристаллическое вещество с характерным резким запахом. При хранении на воздухе и на свету он постепенно окисляется и приобретает розовую или красно-бурую окраску. Температура плавления фенола — $40,9 ^\circ C$, температура кипения — $181,7 ^\circ C$. Фенол ограниченно растворим в холодной воде (образует эмульсию), но хорошо растворяется в горячей воде (выше $66 ^\circ C$), а также в органических растворителях (спирте, эфире, ацетоне) и растворах щелочей. Фенол ядовит, при попадании на кожу вызывает ожоги.
Ответ: Фенол – это бесцветное кристаллическое вещество с резким запахом, ограниченно растворимое в холодной воде, ядовитое.
4. Химические свойства
Химические свойства фенола определяются наличием гидроксильной группы и бензольного кольца, а также их взаимным влиянием.
а) Кислотные свойства (реакции по связи O–H)
Фенол проявляет более сильные кислотные свойства, чем вода и спирты, но является очень слабой кислотой (слабее угольной).
- Взаимодействует с активными металлами: $2C_6H_5OH + 2Na \rightarrow 2C_6H_5ONa \text{ (фенолят натрия)} + H_2 \uparrow$
- Взаимодействует со щелочами (в отличие от спиртов): $C_6H_5OH + NaOH \leftrightarrow C_6H_5ONa + H_2O$
- Феноляты легко разлагаются более сильными кислотами, даже угольной: $C_6H_5ONa + CO_2 + H_2O \rightarrow C_6H_5OH \downarrow + NaHCO_3$
б) Реакции по бензольному кольцу (электрофильное замещение)
Гидроксильная группа является сильным активатором и ориентантом I рода (направляет заместители в орто- и пара-положения).
- Галогенирование (качественная реакция). С бромной водой фенол реагирует мгновенно с образованием белого осадка 2,4,6-трибромфенола:
$C_6H_5OH + 3Br_2 \rightarrow C_6H_2Br_3OH \downarrow + 3HBr$
- Нитрование. С разбавленной азотной кислотой образуется смесь орто- и пара-нитрофенолов. С концентрированной азотной кислотой образуется 2,4,6-тринитрофенол (пикриновая кислота):
$C_6H_5OH + 3HNO_{3(конц.)} \xrightarrow{H_2SO_4} C_6H_2(NO_2)_3OH + 3H_2O$
в) Качественная реакция на фенолы
При взаимодействии с раствором хлорида железа(III) ($FeCl_3$) фенол даёт характерное фиолетовое окрашивание из-за образования комплексного соединения.
г) Другие реакции
- Гидрирование: при каталитическом гидрировании фенол превращается в циклогексанол:
$C_6H_5OH + 3H_2 \xrightarrow{Ni, t, p} C_6H_{11}OH$
- Поликонденсация: с формальдегидом фенол образует фенолформальдегидные смолы.
Ответ: Фенол проявляет слабые кислотные свойства (сильнее, чем у спиртов) и вступает в реакции электрофильного замещения по бензольному кольцу (галогенирование, нитрование) значительно легче, чем бензол, благодаря активирующему влиянию гидроксильной группы.
5. Получение
В промышленности фенол получают несколькими способами. Основным на сегодняшний день является кумольный способ, который заключается в двухстадийном синтезе из бензола и пропена. На первой стадии получают кумол (изопропилбензол), который затем окисляют кислородом воздуха до гидропероксида кумола. На второй стадии гидропероксид разлагают серной кислотой на два ценных продукта — фенол и ацетон.
1. $C_6H_5CH(CH_3)_2 + O_2 \rightarrow C_6H_5C(CH_3)_2OOH$
2. $C_6H_5C(CH_3)_2OOH \xrightarrow{H_2SO_4, t} C_6H_5OH + CH_3COCH_3$
Исторически важными, но устаревшими методами являются выделение из каменноугольной смолы и щелочной гидролиз хлорбензола.
Ответ: Основным промышленным методом получения фенола является кумольный способ, заключающийся в окислении изопропилбензола (кумола) с последующим кислотным расщеплением гидропероксида кумола на фенол и ацетон.
6. Применение
Фенол является важным многотоннажным продуктом химической промышленности. Основные направления его использования:
- Производство полимеров: фенолформальдегидных смол (бакелит), поликарбонатов, эпоксидных смол, используемых для изготовления пластмасс, клеев, лаков, изоляционных материалов.
- Синтез капролактама, из которого получают синтетическое волокно капрон (нейлон-6).
- Производство лекарственных препаратов (аспирин, салол, фенацетин), антисептиков (ксероформ), красителей (фенолфталеин).
- Синтез средств защиты растений (пестицидов, гербицидов).
- Ранее разбавленный водный раствор фенола (карболовая кислота) широко применялся в медицине как антисептик для дезинфекции.
Ответ: Фенол широко применяется в химической промышленности для производства полимеров (фенолформальдегидных смол), лекарственных средств (аспирин), красителей, антисептиков и других органических веществ.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 6 расположенного на странице 110 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6 (с. 110), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.




















