Номер 7, страница 145 - гдз по химии 10 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: коричневый
ISBN: 978-5-09-088084-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 10 классе
Глава VIII. Сложные эфиры. Жиры. Параграф 30. Жиры. Моющие средства. Подумайте, ответьте, выполните... - номер 7, страница 145.
№7 (с. 145)
Условие. №7 (с. 145)
скриншот условия

7. При стирке белья в жёсткой воде расход мыла значительно увеличивается. Почему? Ответ поясните уравнениями реакций.
Решение. №7 (с. 145)

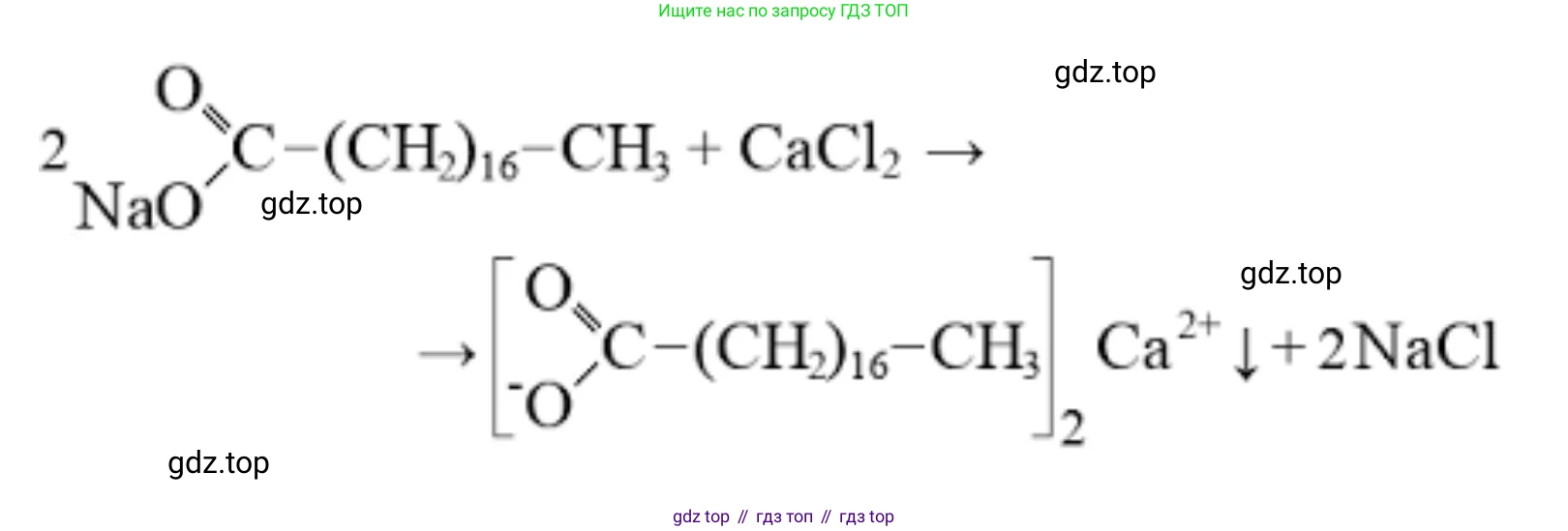
Решение 2. №7 (с. 145)
7. Расход мыла при стирке в жёсткой воде увеличивается из-за химической реакции между моющими компонентами мыла и ионами металлов, определяющими жёсткость воды.
Жёсткость воды — это свойство, обусловленное наличием в ней растворенных солей, главным образом кальция ($Ca^{2+}$) и магния ($Mg^{2+}$).
Обычное твёрдое мыло с химической точки зрения представляет собой натриевые (или калиевые для жидкого мыла) соли высших жирных кислот, например, стеарат натрия ($C_{17}H_{35}COONa$). Эти соли хорошо растворяются в воде и именно их молекулы обладают моющим действием, образуя пену и эмульгируя жиры.
Когда такое мыло попадает в жёсткую воду, происходит реакция ионного обмена. Растворимые натриевые соли жирных кислот реагируют с ионами кальция и магния. В результате образуются нерастворимые в воде кальциевые и магниевые соли жирных кислот. Эти вещества выпадают в осадок в виде серовато-белых хлопьев (так называемый "мыльный шлак") и не обладают моющими свойствами.
Этот процесс можно описать следующими уравнениями реакций:
1. Взаимодействие стеарата натрия (компонент мыла) с ионами кальция:
$2C_{17}H_{35}COONa_{\text{(растворим, моющее средство)}} + Ca^{2+}_{\text{(из жёсткой воды)}} \rightarrow (C_{17}H_{35}COO)_2Ca \downarrow_{\text{(нерастворимый осадок)}} + 2Na^+$
2. Взаимодействие стеарата натрия с ионами магния:
$2C_{17}H_{35}COONa_{\text{(растворим, моющее средство)}} + Mg^{2+}_{\text{(из жёсткой воды)}} \rightarrow (C_{17}H_{35}COO)_2Mg \downarrow_{\text{(нерастворимый осадок)}} + 2Na^+$
Таким образом, значительная часть мыла расходуется не на стирку, а на "умягчение" воды — то есть на связывание ионов $Ca^{2+}$ и $Mg^{2+}$ в нерастворимый осадок. Только после того, как все ионы жёсткости будут удалены из раствора, мыло начнёт пениться и выполнять свою моющую функцию. Это и является причиной его повышенного расхода.
Ответ: Расход мыла в жёсткой воде увеличивается, потому что оно реагирует с ионами кальция и магния, содержащимися в воде, с образованием нерастворимых солей (осадка), которые не обладают моющим действием. В результате часть мыла расходуется на "нейтрализацию" жёсткости воды, и лишь затем оставшееся мыло начинает стирать.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 7 расположенного на странице 145 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7 (с. 145), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.




















