Номер 3, страница 37 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава II. Химические реакции в водных растворах. §8. Химические свойства солей как электролитов. Часть 2 - номер 3, страница 37.
№3 (с. 37)
Условие. №3 (с. 37)
скриншот условия

3. Составьте уравнения реакций, соответствующих следующим превращениям:
$Cl_2 \rightarrow HCl \rightarrow NaCl \rightarrow AgCl \rightarrow Ag$
Расставьте коэффициенты в окислительно-восстановительных реакциях с помощью метода электронного баланса. Для реакций с участием электролитов напишите полные и сокращённые ионные уравнения.
1)
Решение. №3 (с. 37)
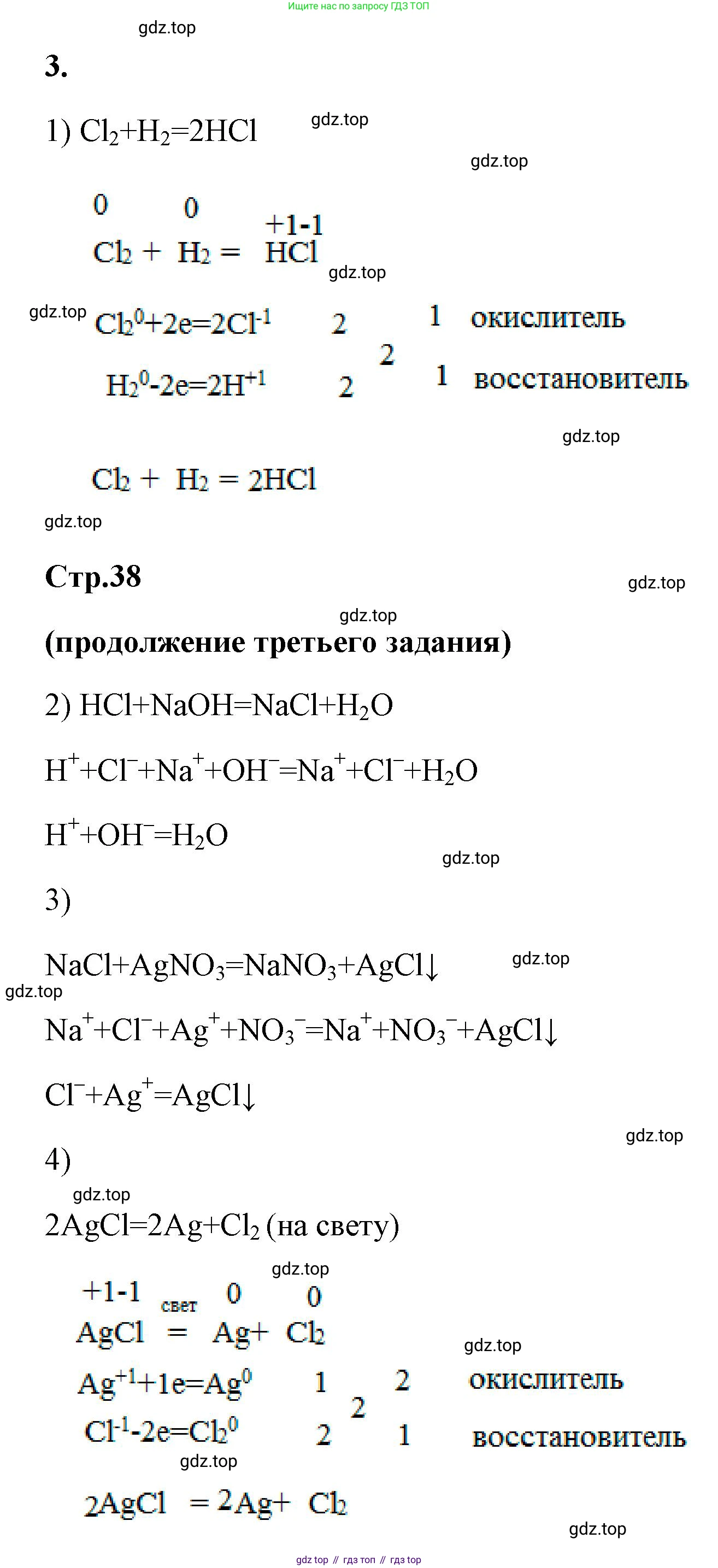
Решение 2. №3 (с. 37)
1) $Cl_2 \rightarrow HCl$
Для получения хлороводорода (HCl) из хлора ($Cl_2$) проведем реакцию хлора с водородом ($H_2$) при нагревании или на свету.
Молекулярное уравнение реакции:
$Cl_2 + H_2 \rightarrow 2HCl$
Эта реакция является окислительно-восстановительной. Расставим коэффициенты с помощью метода электронного баланса.
Определим степени окисления элементов:
$Cl_2^0 + H_2^0 \rightarrow 2H^{+1}Cl^{-1}$
Составим полуреакции:
$H_2^0 - 2e^- \rightarrow 2H^{+1}$ | 1 (процесс окисления, $H_2$ - восстановитель)
$Cl_2^0 + 2e^- \rightarrow 2Cl^{-1}$ | 1 (процесс восстановления, $Cl_2$ - окислитель)
Коэффициенты в уравнении уже расставлены верно. Так как в реакции участвуют простые вещества (газы), а продукт - газ, который затем растворяют в воде для получения кислоты, ионные уравнения для самой реакции синтеза не составляются.
Ответ: $Cl_2 + H_2 \rightarrow 2HCl$
2) $HCl \rightarrow NaCl$
Для получения хлорида натрия (NaCl) из соляной кислоты (HCl) проведем реакцию нейтрализации с гидроксидом натрия (NaOH).
Молекулярное уравнение реакции:
$HCl + NaOH \rightarrow NaCl + H_2O$
Это реакция ионного обмена, она не является окислительно-восстановительной, так как степени окисления элементов не изменяются.
Так как в реакции участвуют сильная кислота, сильное основание и образуется растворимая соль, составим полные и сокращенные ионные уравнения.
Полное ионное уравнение:
$H^+ + Cl^- + Na^+ + OH^- \rightarrow Na^+ + Cl^- + H_2O$
Сокращенное ионное уравнение (после сокращения одинаковых ионов $Na^+$ и $Cl^-$ в обеих частях):
$H^+ + OH^- \rightarrow H_2O$
Ответ: $HCl + NaOH \rightarrow NaCl + H_2O$
3) $NaCl \rightarrow AgCl$
Для получения нерастворимого хлорида серебра (AgCl) из хлорида натрия (NaCl) добавим к его раствору раствор нитрата серебра ($AgNO_3$).
Молекулярное уравнение реакции:
$NaCl + AgNO_3 \rightarrow AgCl \downarrow + NaNO_3$
Это реакция ионного обмена, она не является окислительно-восстановительной. В результате реакции выпадает белый творожистый осадок хлорида серебра.
Так как в реакции участвуют растворимые соли и образуется осадок, составим ионные уравнения.
Полное ионное уравнение:
$Na^+ + Cl^- + Ag^+ + NO_3^- \rightarrow AgCl \downarrow + Na^+ + NO_3^-$
Сокращенное ионное уравнение (после сокращения одинаковых ионов $Na^+$ и $NO_3^-$ в обеих частях):
$Ag^+ + Cl^- \rightarrow AgCl \downarrow$
Ответ: $NaCl + AgNO_3 \rightarrow AgCl \downarrow + NaNO_3$
4) $AgCl \rightarrow Ag$
Для получения металлического серебра (Ag) из хлорида серебра (AgCl) можно использовать реакцию фотохимического разложения, которая происходит под действием света.
Молекулярное уравнение реакции:
$2AgCl \xrightarrow{h\nu} 2Ag + Cl_2 \uparrow$
Эта реакция является окислительно-восстановительной. Расставим коэффициенты с помощью метода электронного баланса.
Определим степени окисления элементов:
$2Ag^{+1}Cl^{-1} \rightarrow 2Ag^0 + Cl_2^0$
Составим полуреакции:
$2Cl^{-1} - 2e^- \rightarrow Cl_2^0$ | 1 (процесс окисления, ион $Cl^-$ - восстановитель)
$Ag^{+1} + 1e^- \rightarrow Ag^0$ | 2 (процесс восстановления, ион $Ag^+$ - окислитель)
Коэффициенты расставлены. В данной реакции участвуют твердые вещества и образуется газ, поэтому ионные уравнения не составляются.
Ответ: $2AgCl \xrightarrow{h\nu} 2Ag + Cl_2 \uparrow$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 3 расположенного на странице 37 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 37), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















